|
高一化学竞赛试卷 2008年六安二中高一化学竞赛试卷 安徽省六安二中 魏 根提供 (考试时间:120分钟,满分:100分) 第I卷(选择题,共48分) 一、选择题(每小题2分,共48分;每小题只有一个选项符合题意。) 1.为了及时发现煤气泄露,常在煤气中加入少量有特殊气味的乙硫醇(C2H5SH)。乙硫醇在煤气燃烧过程中也可燃烧,其充分燃烧时反应的化学方程式为: A.H2SO4 B.SO3 C.SO2 D.CO 2.Se是人体必需微量元素,下列有关 A. C. 3.科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是( )。 A.“四中子”不显电性 B.“四中子”的质量数为4,其质量比氢原子大 C.第二种粒子是氧元素的另一种同位素 D.第二种粒子的化学式为O4,与O2互为同素异形体 4.下列物质的名称分别是( )。
试综合上述命名规律,分析思考后回答K2CS3的名称是 A.三硫代碳酸钾B.三硫碳化钾 C.过硫碳酸钾 D.超硫代碳酸钾 5.下列叙述正确的是( )。 A .NaCl溶液在电流的作用下电离为钠离子和氯离子 B. 溶于水后能电离出氢离子的化合物都是酸 C. 尽管BaSO4难溶于水,但它仍然是强电解质 D.二氧化碳溶于水后能部分电离,所以二氧化碳是弱电解质 6.分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )。 A.H2SO4是酸,因为H2SO4中含有H元素 B.豆浆是胶体,因为豆浆中的分散质粒子直径在1 nm~100 nm之间 C.Na和H2O的反应不是离子反应,因为反应中没有离子参加 D.Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧 7.下列离子中,电子数大于质子数且质子数大于中子数的是( )。 A. D3O+ B. Li+ C. OH? D.OD? 8.氢化钙可作生氢剂,反应方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是( ) A.溶剂 B.还原剂 C.氧化剂 D.既作还原剂又氧化剂 9.一定温度下向饱和KOH溶液中投入一小块金属K,充分反应后恢复到原来的温度。下列叙述中合理的是( )。 A.KOH溶液浓度增大,并放出H2 B.溶液中KOH的质量分数不变,有H2放出 C.总溶液的质量增大,有H2放出 D.总溶液的质量不变,有H2放出 10.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )。
A.原子半径:W>Z>Y>X B.最高价氧化物对应水化物的酸性:Z>W>X C.相等物质的量浓度的气态氢化物溶液pH:X>Z>W D.四种元素的单质中,W单质的熔、沸点最高 11.下列叙述中(NA表示阿伏加德罗常数),不正确的是( )。 A.6.8 g熔融的KHSO4中含有0.05 NA个阳离子 B.0.1 mol Na2O2晶体中含有0.1 NA个阴离子 C.在25 ℃时,1L1mol/L醋酸溶液中所含分子的个数大于NA D.在标准状况下的22.4 L辛烷完全燃烧,生成的二氧化碳的分子数为8NA 12.某不纯的MnO2粉末,其中只含一种杂质,经测定含氧质量分数为35.8%,则这种杂质可能是( )。 A.MgO B.SiO2 C.CuO D.不能确定 13、以CuO.BaCO3和Y2O3为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成这种高温超导物质0.5 mol,理论上需取用Y2O3.BaCO3和CuO的物质的量(mo1)依次为( )。 A. 0.50; 0.50; 0.50 B.1.5; 1.0; 0.50 C. 0.25; 1.0; 1.5 D.0.17; 0.25; 1.0 14、下列实验选用试剂不正确的是( )。 A.用稀盐酸清洗做焰色反应的铂丝 B.用酒精萃取碘水中的碘 C.用稀硝酸洗去残留在试管壁上的铜 D.用碱石灰吸收氨气中的水蒸气 15.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol / L和b mol / L。则a与b的关系为( )。 A.a = b B.a = 2b C.2a = b D.a = 5b 16.“绿色化学”是指从技术.经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应,不符合绿色化学概念的是( )。 A.消除硫酸厂尾气排放:SO2+NH3+H2O=(NH4)2SO3 B.消除制硝酸工业尾气的氮氧化物污染:NO2+NO+NaOH=2NaNO2+H2O C.制CuSO4:Cu+2H2SO4(浓)=CuSO4+SO2+2H2O D.制CuSO4:2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O 17.“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是 ( )。 A.反应生成的大量白烟是氯化钠晶体 B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 C.钠着火燃烧产生苍白色火焰 D.若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收 18.将两种不同浓度的硫酸等质量混合,混合液的密度为d1;等体积混合,混合液的密度为d2。将两种不同浓度的酒精等质量混合,混合液的密度为d3;等体积混合,混合液的密度为d4。下列判断正确的是( )。 A.d1 ﹥d2 ﹥d3 ﹥d4 B.d4 ﹥d3 ﹥d2 ﹥d1 C.d3 ﹥d4 ﹥d1 ﹥d2 D.d2 ﹥d1 ﹥d4 ﹥d3 19.化学实验中经常需要用蒸馏水冲洗已用自来水洗净的烧杯。设洗后烧杯内残留“自来水”为1 mL,用20 mL蒸馏水洗2次,烧杯中残留的“自来水的浓度”为原来的( )。 A.1/20 B.1/21 C.1/441 D、无法计算 20.下列各组离子一定能大量共存的是( )。 A.含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN- B.在强碱溶液中:Na+、K+、AlO2-、CO32- C.与铝反应生成H2的溶液中:NH4+、Al3+、SO42-、NO3- D.在酸性溶液中:K+、Fe2+、Cl-、NO3- 21.在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8 g镁条,向右边烧杯中加入10.8 g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是( )。 A.先偏左,最后偏右 B.先偏右,最后偏左 C.先偏左,最后平衡 D.先偏右,最后平衡 22.下列离子方程式正确的是( )。 A.漂白粉溶液中通入二氧化硫:Ca2+ + 2ClO- + H2O + SO2== CaSO3↓+ 2HClO B.将1molCl2通入含1molFeBr2的溶液中:2Cl2 + 2Fe2+ +2Br-=Br2+2Fe3+ +4Cl- C.碳酸钡中加入稀硫酸:BaCO3 + 2H+ == Ba2+ + CO2↑+ H2O D.水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiO3 + 2H+ == H2SiO3↓+ 2Na+ 23.有一种硫化钠、亚硫酸钠和硫酸钠的混合物,经测定含硫25.6%,则此混合物含氧量是( )。 A.36.8% B.37.6% C.51.2% D.无法计算 24.在水溶液中,YO3n-和S2-发生反应的离子方程式为:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则YO3n-中Y元素的化合价和Y原子最外层电子数分别为( )。 A.+4 ,4 B.+5,5 C.+5,7 D.+7,7 第II卷(非选择题,共52分) 二.填空题(包括6大题,共45分) 25.(6分)(1)有8个试剂瓶,分别盛有下面8种溶液:①硫酸铜溶液,②小苏打溶液,③碘酒溶液,④稀硝酸溶液,⑤醋酸溶液,⑥高锰酸钾溶液,⑦烧碱溶液,⑧75%酒精溶液。请根据一定的分类标准,从中任意选出三种。它们的溶质的化学式是 ,将它们归为一类的依据是 。 (2)硫酸铵在一定温度下分解:4(NH4)2SO4 → 6NH3 + N2 + 3SO2+ SO3 + 7H2O,当有1 mol电子转移时,有______mol氮被氧化,同时有_______mol硫被还原。 (3)ZSM—5分子筛是由多个结构单元构成的,其中一个结构单元的化学式可表示为Si96O192。若用4个铝原子取代其中的4个硅原子,形成的原子团所带的负电荷数为 ,若用铵根离子与它结合成电中性,这些铵根离子中共含有 个氢原子 26.(3分)(1)下列实验操作中,正确的是 。 A.称量固体药品时,将药品直接放在天平托盘上 B.实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭洒精灯 C.先将pH试纸用蒸馏水润湿后,再测定溶液的pH D.用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物 E.用98%浓硫酸配制100 g 10%的稀硫酸溶液时,除使用量筒外还需用到容量瓶 F.金属钠不慎燃烧立即用沙子覆盖 27.(4分)已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小。图中容器A是一种特制的有底的素瓷烧筒,他的 壁可以通过气体分子。实验开始时,A中和烧杯中部充满空气。当向烧杯中持续通入氢气时,导管B处发生的现象是: ,产生这种现象的原因是: 。 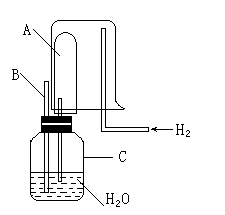 28. (10分)已知有以下物质的相互转化关系,A是常见的金属单质,能被磁铁吸引。 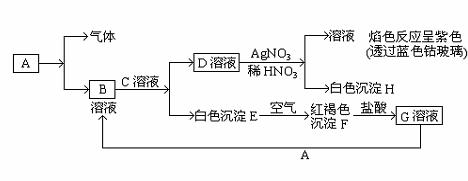 试回答:⑴ 写出B的化学式 D的化学式 。 ⑵ 写出由E转变成F的化学方程式 。 ⑶ 写出用KSCN鉴别G溶液的离子方程式 ;向G溶液加入A的有关离子反应方程式 。 29(12分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: 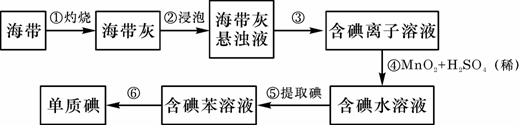 请填写下列空白: (1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 。 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。 A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器 (2)步骤③的实验操作名称是 ; 步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。 (3)步骤④的目的是: 。 (4)步骤⑤中,某学生选择用苯来提取碘的理由是: 。 (5)请设计一个简单实验,检验提取碘后的水溶液中是否还含有单质碘。 。 30.(10分)A、B、C、D是短周期中的四种元素,它们的原子序数一次增大,其中A、C与B、D分别是同主族元素。A与C,B与C都可形成原子个数比为1:1,2:1的化合物。 (1)写出上述四种元素的名称:A、 B、 C、 D、 (2)分别写出A与C,B与C按照原子个数1:1形成的化合物的电子式: ; (3)写出同时含有A、B、C、D四种元素组成的两种化合物之间反应的离子方程式: 三、计算题 31.(7分)金属锡(Sn)的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为:Sn+2HCl=SnCl2+H2↑再加入过量FeCl3溶液,发生如下反应: SnCl2+2FeCl3=SnCl4+2FeCl2 最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+离子,反应的化学方程式为: 6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O 现有金属锡试样0.613 g,经上述各步反应后,共用去0.100 mol / L K2Cr2O7溶液16.0 mL。求试样中锡的百分含量(假定杂质不参加反应)。 2008年六安二中高一化学竞赛试卷 (考试时间2小时,满分100分) 答 题 卷 一、选择题(每小题2分,共48分。)
二、填空题 25.(6分) (1) (2) mol mol (3) 26.(3分) 27. (4分) 28. (10分) (1)B的化学式: 、D的化学式: (2)E转变成F的化学方程式: (3)鉴别G溶液的离子方程式: G溶液中加A的离子反应方程式: 29.(12分) (1) 。 (2) 、 。 (3) 。 (4) 。 (5) 30.(10分) (1)A、 B、 C、 D、 。 (2) ; (3) 。 31.计算题 2008六安二中高一化学竞赛试题参考答案 一、选择题(本题包括24小题,每小题2分,共48分;每小题只有一个选项符合题意。)
二.填空题(包括6大题,共45分) 25.(6分)(1) CuSO4、NaHCO3、KMnO4 同属于盐类 (2) 1/3 1/2 (3)4;16 26.(3分)B、F 27.(4分)液面上升;氢气相对分子质量小,运动速度快,单位时间进入烧筒的量多,逸出的氧气、氮气多,使广口瓶气体压力大,使水压入B导管 28.(10分)⑴ FeCl2, KCl; ⑵ 4 Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3。 ⑶ Fe3+ +3SCN -== Fe(SCN)3,2Fe3+ +Fe == 3Fe2+。 29.(12分)(1)BDE (2)过滤、蒸馏 (3)将碘离子(I-)氧化为碘单质(I2) (4)苯不溶于水,碘单质在苯中的溶解度远大于在水中的溶解度。 (5)取少量水溶液于试管中,滴加几滴淀粉溶液,如溶液变蓝,则说明有,反之则无。 30.(10分)(1)氢、氧、钠、硫(2)略(3)HSO3—+H+=SO2↑+H2O 三.计算题 31. (7分)反应中消耗的K2Cr2O7的物质的量为: 0.100 mol / L×0.0160 L=1.60×10-3 mol 6×K2Cr2O7物质的量=FeCl2物质的量;FeCl2物质的量=2×SnCl2物质的量, SnCl2的物质的量=6× Sn的质量为4.8×10-3 mol×119 g / mol=0.571 g 试样中Sn的百分含量为 或列成一个总式: 下载: (责任编辑:admin) |
