|
2008高中化学竞赛初赛模拟试卷(4) 湖南湘乡四中 龙威 第[一]题(4分) 某元素的离子R2+有5个电子层,最外层有2个电子,R(NO3)2是它的一种常见盐。R的元素符号是 ,R元素在周期表中的位置是 ,配制澄清R(NO3)2溶液的方法是 。 第[二]题(5分) 铋的化合物丰富多彩。在液态SO2中,AsF5或其他五氟化物能氧化铋,其中能生成化合物A。经分析,A为离子化合物,阳离子为多个铋原子组成的三角双锥型原子簇,阴离子为正八面体结构。已知A的阳离子中铋原子全部为8电子结构。 1.试确定A的结构简式; 2.写出生成A的化学反应方程式。 第[三]题(16分) 来自日本的SK-Ⅱ品牌多项化妆品中被查出含有禁用的铬钕成分。铬为皮肤变态反应原,可引起过敏性皮炎或湿疹,病程长、久而不愈;钕对眼睛和黏膜有很强的刺激性,对皮肤有中度刺激性,吸入还可导致肺栓塞和肝损害。 1.钕的元素符号Nd,原子序数60,淡黄色,在空气中容易氧化,用来制合金和光学玻璃等。 (1)钕在元素周期表中的位置为 ;价电子构型为 ;次外层上电子数为 。 (2)已知E0Nd3+/Nd=-2.431 V,判断其能否与盐酸反应。若能写出反应方程式;不能说明理由。 (3)已知Nd晶体为六方晶格(密堆积),原子半径r=182.2 pm,计算其密度。 (4)最强永磁体钕铁硼的合金中B的含量为1.0000%,确定其简单组成(相对1个B); (5)钕能与一些普通元素形成混合氧化物,如掺钕的钇铝石榴石晶体可用于激光发射,已知该钕化合物含Nd为56.97%,写出化学式。 2.研究表明,人体内若含铬量超过1 mg就足以致人于死地,铬在人体内的作用是协同胰岛素清除多余的葡萄糖,人体内的铬主要经尿排出。 (1)铬是人体的必需元素吗?三价铬和六价铬哪种对人危害大? (2)人体内哪个器官含铬量最高? (3)年纪大的人易患糖尿病,这与铬是否有关系? 3.糖皮质激素地塞米松也是化妆品中的常见违禁成分,其结构简式如下图。 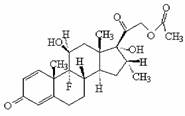 (1)能否与NaOH反应,为什么? (2)在Cu的催化氧化下,与O2反应的比例如何? (3)存在多少个对映异构体? 第[四]题(5分) 2005年2月14日新华社报道,我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金X/XH6(合金X的晶胞如图所示),另一电极为NiO(OH)/Ni(OH)2。 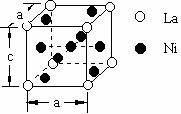 1.据图写出X的化学式; 2.据图计算La的配位数; 3.写出放电时的负极反应; 4.写出充放电的总反应方程式。 第[五]题(8分) 往1.0 L密闭容器中加入NO2和N2O4各1.0 mol,当反应达到平衡时容器中还剩余0.70 mol N2O4(N2O4浓度变化如下图所示,恒容)。 1. 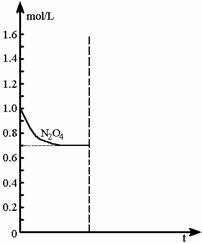 请在图中补充NO2浓度的变化; 请在图中补充NO2浓度的变化;2.如果将容器的体积缩小到0.5 L(保持恒容),请在图中画出NO2、N2O4重新达到平衡的图象。 第[六]题(8分) 专家指出,摄入过多的反式脂肪酸,会导致心脑血管疾病、糖尿病,儿童若摄入过多将会影响身体发育。人造奶油、酥烤类食品、快餐中的炸鸡和炸薯条均含这种物质。反式脂肪酸是指至少含一个反式构型双键的脂肪酸,即碳碳双键上两个碳原子结合的氢原子分别位于双键的两侧。已知油酸的结构简式为CH3(CH2)7C=C(CH2)7COOH。 1.写出油酸的顺式和反式立体结构,并分别命名; 2.比较顺式脂肪酸和反式脂肪酸的熔熔点高低; 3.比较顺式脂肪酸和反式脂肪酸能量高低,说明判断理由 4.血液中反式脂肪酸含量过高易导致心脑血管疾病,为什么? 第[七]题(9分) 化合物X与CO32-是等电子体,可用CoF3在300 ℃时与NO2反应制得。 1.确定X的化学式,指出X中中心原子的杂化形态。 2.X也可用无水硝酸和氟代磺酸反应制备。试写出其化学反应方程式,并指明反应类型。 3.X能发生水解反应。试分别写出X与NaOH和乙醇反应的化学方程式。 4.X能与BF3反应,试写出其化学反应方程式,并预测B-F键长变化趋势,简述其原因。 第[八]题(10分) NH4Cl为CsCl型结构,晶胞中包含1个NH4+和1个Cl-,晶胞参数a=387 pm。把等物质的量的NH4Cl和HgCl2在密封管中一起加热时,生成NH4HgCl3晶体,晶胞参数a=b=419 pm、c=794 pm(结构如下图)。 1.已知Cl-半径为181 pm,求NH4+(视为球形离子)的半径。 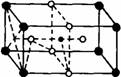 2.计算NH4HgCl3晶体的密度; 3.指出Hg2+和NH4+的Cl-具体配位形式; 4.通过具体计算,指出晶体中Cl-与Cl-之间的最短距离是多少? 第[九]题(6分) 将V2O5溶于草酸,再滴入H2O2-KOH混合溶液,得到一种带有2份结晶水的钾盐沉淀X。已知X中含13.68%的V和47.27%的O。 1.通过计算确定X的化学式; 2.写出X的合理结构简式 3.画出X的结构式。 第[十]题(9分) 称取液体A 464.7 mg,使之溶于水中,溶液具有明显的酸性。需要6.000 mmol的Ba(OH)2才能中和它,同时溶液中产生沉淀B 760.0 mg。过滤出沉淀并洗涤后用稀H2SO4处理,沉淀B转化为一溶液C,与此同时又产生一新沉淀D 700.2 mg,B、D类质同晶。溶液C中加入过量的KI后、用S2O32-滴定,耗去0.3000 moL/L的Na2S2O3溶液30.00 mL。 1.试确认各符号所代表的化合物; 2.写出A与Ba(OH)2反应的总方程式; 3.写出C与过量KI反应的离子方程式; 4.A的蒸气可以用中性亚硫酸钠溶液吸收,写出反应方程式。 第[十一]题(12分) 配位化合物A是单核配合物分子,由11个原子组成;微热后失重11.35%得到B;B进一步加热又失重26.66%(相对B)得到金属C;B极难溶于水,不溶于乙醇、乙醚,能溶于盐酸。A有2种异构体A1、A2,其中A2能与草酸盐反应得到一种式量比A略大的配合物分子D(A1无相似反应) 1.写出A、B、C的化学式; 2.写出B溶于盐酸后产物的名称; 3.试画出A1、A2、D的结构,并比较A1、A2在水中溶解性的大小。 4.A还有若干种实验式相同的离子化合物。它们每个还满足如下条件:是由分立的、单核的离子配合物实体构成的;仅含1种阳离子和1种阴离子。 (1)符合上述条件的离子化合物的精确的分子式有多少种。 (2)其中1种与AgNO3反应(物质的量之比为1︰2)得到两种组成不同的配合物,写出反应的化学方程式。 第[十二]题(8分) 洛索洛芬是一种非甾体抗炎镇痛药,具有较强的抗炎、镇痛、解热作用。右图所示结构是其重要中间体。 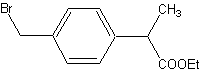 请从苯、甲苯、苯磺酸、对甲基苯磺酰氯、三乙胺、甲醛、丙酸乙酯、乳酸乙酯、N-溴代丁二酰亚胺及无机试剂,合成该中间体(限用具有高产率的各反应,标明合成的各个步骤)。 参考答案 第[一]题(4分) Sn(1分) 第五周期ⅣA族(1分) 将Sn(NO3)2溶于少量稀HNO3,并加入Sn粒防氧化(2分) 第[二]题(5分) 1.A:Bi5(AsF6)3(3分); 2.10Bi+9AsF5=2Bi5(AsF6)3+3AsF3(2分)。 第[三]题(16分) 1.(1)第六周期ⅢB族(或镧系) 4f46s2 8(各1分) (2)2Nd+6H+=Nd3++3H2↑(1.5分) (3)ρ=4M/NA(2 (4)Nd2Fe14B(1.5分) (5)Nd3Al5O12(1.5分) 2.(1)是 六价铬(各0.5分) (2)肾(0.5分) (3)随着年龄增加,人体内含铬量就会减少(1分) 3.(1)具有1个酯的结构,水解得到醇和乙酸钠(1分) (2)与O2以物质的量2︰1反应(1分) (3)28=256(2分) 第[四]题(5分) 1.LaNi5(1分) 2.18(1.5分) 3.LaNi5H6+6OH--6e-=LaNi5+6H2O(1分) 4.LaNi5H6+6NiO(OH) 第[五]题(8分) 1.如图,必需同时达到平衡(2分) 2.压缩到0.5 L后浓度立即达到原来的2倍(1分) 反应2NO2 设新平衡时N2O4为x mol,则(x/0.5)/[(3-2x)/0.5]2=Kc(1分) 解得x=0.87 mol(1分) 即c(N2O4)=1.74 mol/L、c(NO2)=2.52 mol/L(1分) 如图,必需同时达到平衡(1分) 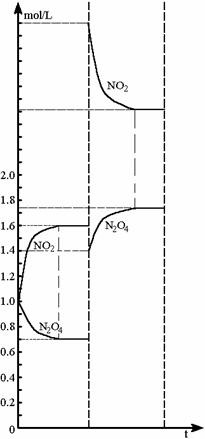 第[六]题(8分) 1.顺: 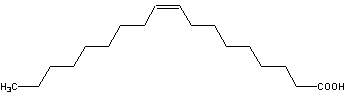 (1分) (1分)反: 顺:Z-9-烯十八酸 反:E-9-烯十八酸(1分) 2.顺式结构沸点高(1分) 熔点低(1分) 3.反式脂肪酸能量高,因为顺式脂肪酸加热易变成反式脂肪酸(1.5分) 4.熔点高,易堵塞血管(1.5分) 第[七]题(9分) 1.X:FNO2 X中N原子的杂化形态为sp2。(各1分) 2.HNO3+FSO3H=FNO2+H2SO4;该反应为取代反应。(各1分) 3.FNO2+2NaOH=NaNO3+NaF+H2O;FNO2+C2H5OH=C2H5ONO2+HF。(各1分) 4.FNO2+BF3=NO2BF4(1分);B-F键长增大,原因是BF3中存在大π 第[八]题(10分) 1.154 pm(1.5分) 2.ρ=1×325.0/[6.022×1023×(4.19×10-8)2×(7.94×10-8)]=3.87 g/cm3。(1.5分) 3.Hg2+:压扁的正八面体 NH4+:压扁的正四棱柱(各1.5分,无压扁各1分) 4.Cl-的空间环境不同,可分为两类:体内的两个Cl-①为一类;棱边中点的4个Cl-②为另一类。前者距NH4+较近(335 pm),距Hg2+也较近(241 pm);后者距离NH4+ 397 pm,距Hg2+ 296 cm。Cl-①与邻近晶胞的Cl-的距离最短为3.13 pm,Cl-①与Cl-②的距离为382 pm;Cl-②与Cl-②的距离为419 pm。(4分) 第[九]题(6分) 1.V︰O=1︰11,式量:372.3,扣除V、O及4个H剩余141.3,应为3个K,2个C; 化学式为:K3VC2H4O11(2.5分) 2.K3[VO(O2)2(C2O4)]·2H2O(1.5分) 3. 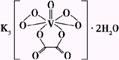 (2分) (2分)第[十]题(9分) 1.A:CrO2Cl2(2分) B:BaCrO4 C:H2Cr2O7 D:BaSO4(各1分) 2.CrO2Cl2+2Ba(OH)2=2BaCrO4+BaCl2+2H2O(1.5分) 3.Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O(1分) 4.2CrO2Cl2+3SO32-+H2O=2Cr(OH)2++4Cl-+3SO42-(1.5分) 第[十一]题(12分) 1.A:Pt(NH3)2Cl2(1.5分) B:PtCl2(1分) C:Pt(1分) 2.四氯合铂(Ⅱ)酸(1分) 3.A1:(1分) B:(1分) D:(1.5分) 在水中溶解度较大的是A2(1分) 4.(1)4种([Pt(NH3)4]重+、[Pt(NH3)3Cl]+与[Pt(NH3)Cl3]-、[PtCl4]2-组合)(1分) (2)[Pt(NH3)4][PtCl4]+2AgNO3=Ag2[PtCl4]+[Pt(NH3)4](NO3)2(2分) 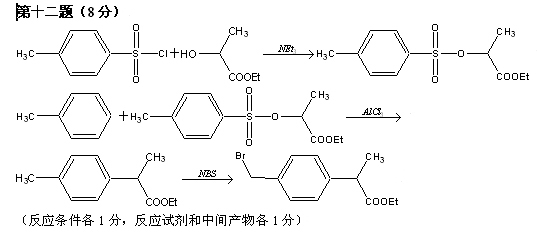 下载: (责任编辑:admin) |
