2008高中化学竞赛初赛模拟试卷(5)
第[一]题(4分)
美国和俄罗斯科学家组成的一个研究小组10月16日宣布,他们成功制造出了门捷列夫元素周期表中的118号元素。他们通过设在俄罗斯杜布纳的U400回旋加速器实验设备,两次将许多钙-48离子加速,用来轰击人造元素锎(Cf)-249,从而制造出3颗新原子:每颗新原子的原子核包含118个质子和179个中子。118号元素原子存在时间仅为0.9毫秒。研究人员观察到了118号元素原子的“衰变链”过程,证实了新元素的存在。其衰变过程中依次释放出一种相同的粒子后得到116、114、112号元素,112号元素最终裂变为两颗大小差不多的其他原子。
1.指出118号元素在周期表中的位置;
2.写出合成118号元素的核反应方程式;
3.指出衰变过程中112号元素样子的质量数。
第[二]题(10分)
为了防止铁制品生绣,可对其表面进行“发蓝”处理:把铁制品浸入热的NaNO2、NaNO3、NaOH混合溶液中,使它的表面氧化成一层致密的Fe3O4氧化膜。其原理是:
①在NaOH溶液中,铁粉与NaNO2溶液发生可逆反应,生成A溶液和气体C。
②在NaOH溶液中,铁粉与NaNO3溶液中发生反应,生成B溶液和气体C。
③生成A和B的溶液能继续发生可逆反应,生成Fe3O4。
经研究发现:A和B的焰色反应均为黄色,其导电性实验均为K2SO4型。气体C具有强烈的刺激性气味。
1.写出并配平化学反应方程式。
2.实践中发现适当提高温度或增大NaNO2溶液的浓度有利于氧化膜增厚,但若NaOH的含量太少或太多,氧化膜的厚度都太薄。请用化学平衡原理解释发生这种现象的原因。
3.发蓝层遇光气(COCl2),若不及时清洗,则发蓝层的完整性将被破坏。写出有关的化学反应方程式。
第[三]题(7分)
近期来上海连续发生“瘦肉精”食物中毒事故,波及全市9个区、300多人。“瘦肉精”的学名盐酸克仑特罗,用作饲料后,猪吃了它能减肥,人吃了它会中毒甚至死亡。自20世纪80年代开始,欧美等世界各国均将其定为禁用药品。另外一种“瘦肉精”的替代品“盐酸莱克多巴胺”也被全面封杀。
1.盐酸克仑特罗的化学名为α-[(叔丁氨基)甲基]-对氨基-3,5-二氯苯甲醇盐酸盐,化学式为C12H18Cl2N2O·HCl。
(1)画出它的结构简式。
(2)在该结构简式上有*标出具有光学活性的原子。
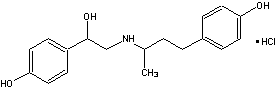 2.盐酸莱克多巴胺结构式如右: 2.盐酸莱克多巴胺结构式如右:
(1)系统命名法命名该物质;
(2)1 mol该物质最多可与NaOH、Br2分别反应的物质的量。
第[四]题(23分)
2006年8月末至今,甘肃省徽县水阳乡有近千人来西安进行血铅检测,373名儿童有90%的儿童血铅超标,最高者血铅含量超标数倍,被诊断为重度铅中毒,成人血铅超标也很普遍。国家环保总局派出专家调查认为,水阳乡新寺村旁的一家铅锭冶炼厂是“罪魁祸首”,公司周边400 m范围内土地已全部被污染。《东方时空》、《焦点访谈》专门对此做了报道,血铅超标的病人正在接受有效治疗。
1.写出Pb2+的核外电子构型。
2.写出下列反应方程式。
(1)将SO2通入棕色PbO2的悬浊液会产生白色沉淀。
(2)使用合适的氧化剂将黑色的PbS变白。
3.铅主要以方铅矿存在于自然界。冶炼厂主要采用火法冶炼铅,首先将矿石与石灰石混合焙烧,分离得到三种含铅化合物的化合物,然后用少量碳作还原剂把铅还原出来。写出上述过程中可能发生的全部化学方程式。
4.铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,写出电池总反应的离子方程式。
5.铅在工业中应用广泛。
(1)为了增强彩釉的亮度,陶瓷业在釉中常加少量的铅,铅在酸性溶液中容易溶解,而进入人体,写出铅“吃醋”的离子反应方程式。
(2)汽车工业为提高发动机的使用寿命,常在汽油中加入一中含铅抗震剂,写出其化学式。
6.从事铅作业的工人应定期体检,多补充维生素、蛋白质等物质,因为铅盐对人的毒害很大。请用具体化学原理说明,多补充蛋白质的作用。
7.将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
(1)通过计算确定y与a、x的函数关系式。
(2)若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质是什么;并确定其物质的量。
8.含铅试样(氧化物)中Pb的含量分析有多种方法,高锰酸钾法是其中之一。称取该样品0.7340 g,加入2 000 mL 0.2500 mol/L草酸溶液,然后用氨水中和溶液得到沉淀。过滤后将沉淀溶解于酸中,用标准KMnO4溶液滴定,用去0.0400 mol/L KMnO4溶液30.25 mL。
(1)计算样品中铅的百分含量。
(2)再给出2种分析铅含量的化学方法。
第[五]题(8分)
金属铜的理想堆积模型为面心立方紧密堆积(CCP),设它的边长为a cm。在晶体中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)面。
1.请画出金属铜的晶胞(○表示Cu原子),并涂黑有代表性的1个(1,1,1)面上的Cu原子。
2.计算(1,1,1)面上Cu占整个面积的百分率以及Cu占整个体积的百分率(给出计算过程)。
3.在1个盛有CuSO4溶液的电解槽内电镀铜,其中阴极经过特殊处理,只有1个(1,1,1)面暴露在电解质溶液中,其余各面均被保护。假设此面面积为bcm2,电镀时电流恒为I。Cu2+在此面上做恒速率均匀沉积,t min后,有一层Cu原子恰好在阴极上沉积完毕,求这是已沉积的第几层Cu原子?(阿伏加德罗常数为NA,法拉第常数为F)
第[六]题(8分)
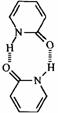
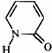 2-吡啶酮(结构简式如右)是一种可以与自身互补的分子,在晶体或溶液中,它以氢键连接的二聚体形式存在。若用乙炔基(-C≡C-)将两个2-吡啶酮连接有两种方式:(a)3、6位连接和(b)6,6位连接。Wuest研究了(a)和(b)的聚集行为,在质子溶剂中(a)和(b)都以单体形式存在;在非质子溶剂中(a)以二聚体形式(c)存在,即使浓度很高时,(b)仍以单体形式存在。在本体状态下,(a)形成分散的二聚体(c),(b)形成了平面的线性超分子聚合物(d),(d)有两种典型的空间构型。 2-吡啶酮(结构简式如右)是一种可以与自身互补的分子,在晶体或溶液中,它以氢键连接的二聚体形式存在。若用乙炔基(-C≡C-)将两个2-吡啶酮连接有两种方式:(a)3、6位连接和(b)6,6位连接。Wuest研究了(a)和(b)的聚集行为,在质子溶剂中(a)和(b)都以单体形式存在;在非质子溶剂中(a)以二聚体形式(c)存在,即使浓度很高时,(b)仍以单体形式存在。在本体状态下,(a)形成分散的二聚体(c),(b)形成了平面的线性超分子聚合物(d),(d)有两种典型的空间构型。
1.指出2-吡啶分子中所成π键的情况;
2.写出2-吡啶酮二聚体的结构简式;
3.写出a、b的结构简式;
4.画出二聚体(c)的结构简式;
5.画出表示聚合物(d)的两种结构片段。
第[七]题(8分)
有机物A分子中有两种不同类型的氢原子,其个数比是1︰1;A不能发生碘仿反应和银镜反应,但能与镁试剂(碘化甲基镁)反应,再水解后生成化合物B。加热B可失水得到主要产物C。C发生臭氧化反应得到D,D能发生碘仿反应生成E,E易失水生成环状化合物。
1.请写出A、B、C、D、E的结构简式。
2.系统命名法命名D。
第[八]题(7分)
某Ⅷ族不活泼金属A溶于足量的王水生成B的溶液(A的含量为47.60%);将SO2通入B的溶液中,得到C的溶液(A的含量为57.56%)。已知B、C的组成元素完全相同,且阴离子所带电荷也相同。
1.通过计算推理,确定A的元素符号;
2.写出所涉及反应的化学方程式。
3.画出B、C阴离子的空间构型。
第[九]题(3分)
已知脊椎动物的骨骼中含有磷。以下是测定动物骨灰中磷元素含量的实验方法。称取某动物骨灰样品0.1030 g,用硫酸和高氯酸在高温下使之分解,过滤、洗涤、弃去残渣,以硫酸-硝酸为介质,加入过量钼酸铵溶液生成钼磷酸铵沉淀(NH4)3H4PMo12O42·H2O,沉淀经灼烧后得到固体质量为0.5040 g。试由上述数据计算该骨灰样品中磷的质量分数。
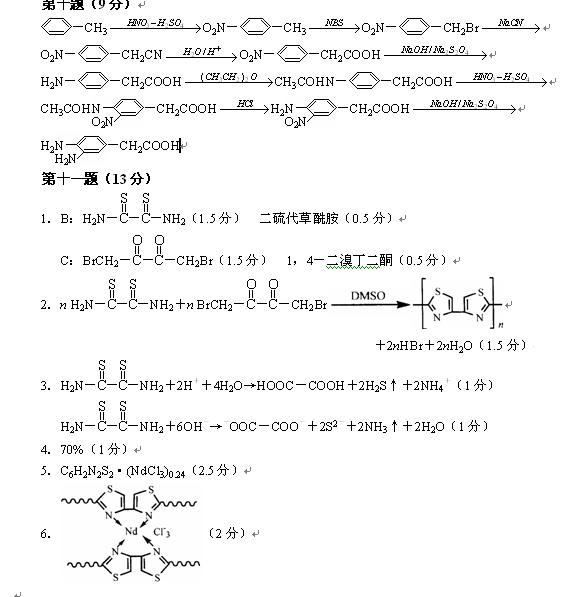
第[十]题(9分)
3,4-二氨基苯乙酸是一种重要的药物中间体;请以甲苯为主要原料,用最佳方法合成(限用具有高产率的各反应,标明合成的各个步骤)
第[十一]题(13分)
聚-2,4-噻唑(A)的结构简式如图所示:
其合成方法如下:称取化学计量比的0.96 g B和1.95 g C溶于30 mL DMSO溶剂中,在氮气的保护下室温 磁力搅拌反应8 h后,将得到的褐色混合物倒入丙酮中沉淀,过滤,将得到的褐色沉淀反复用甲醇、丙酮浸泡,洗涤,过滤,然后在60 ℃下真空烘干,得到褐色产物A 0.93 g。已知A是一种在酸性或碱性条件下都易水解的物质。 磁力搅拌反应8 h后,将得到的褐色混合物倒入丙酮中沉淀,过滤,将得到的褐色沉淀反复用甲醇、丙酮浸泡,洗涤,过滤,然后在60 ℃下真空烘干,得到褐色产物A 0.93 g。已知A是一种在酸性或碱性条件下都易水解的物质。
将合成得到的A称取0.5 g溶于40mL DMSO中,加入3.24 g(过量) NdCl3·6H2O,氮气保护下80 ℃磁力搅拌反应24h,反应结束后倒入400mL水中沉淀,过滤得到黑色产物,反复用大量的水、甲醇浸泡洗涤产物,直到用AgNO3检验滤液中无Cl-为止,过滤,然后在60 ℃下真空烘干,得到黑色产物(D)0.63 g。元素分析D中含C 31.8%,Nd 15.3。
1.写出有机物B、C的结构简式,分别命名;
2.写出B+C→A的反应方程式;
3.分别写出B的酸性和碱性水解反应方程式;
4.计算制取A的产率;
5.计算配合物D中A和NdCl3分子数比,用化学式表示;
6.已知配合物D中Nd是四配位的,画出特征性的配合物的片段。
参考答案
第[一]题(4分)
1.第七周期0族稀有气体元素(1分)
2.48Ca+249Cf→297118(1.5分)
3.285(1.5分)
第[二]题(10分)
1.3Fe+NaNO2+5NaOH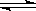 3Na2FeO2+NH3↑+H2O 3Na2FeO2+NH3↑+H2O
8Fe+3NaNO3+5NaOH+2H2O=4Na2Fe2O4+3NH3↑
Na2FeO2+Na2Fe2O4+2H2O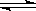 Fe3O4+4NaOH(各1.5分) Fe3O4+4NaOH(各1.5分)
2.由于NaNO2是氧化剂,增大NaNO2浓度可以使反应向生成Fe3O4方向移动;而升高温度可以增强NaNO2、NaNO3的氧化性;应①、③是可逆反应,反应②是不可逆反应,当NaOH含量较少时,使反应①生成的Na2FeO2及反应②生成的Na2Fe2O4的质量都少,致使反应③生成的Fe3O4的质量也少,氧化膜的厚度就薄。当NaOH含量太多时,尽管反应①、②生成的Na2FeO2及Na2Fe2O4的质量增加,但太多的NaOH又会使反应③的化学平衡向逆反应方向移动,结果生成的Fe3O4的质量变小,氧化膜的厚度变薄。(各1分)
3.Fe3O4+4COCl2=2FeCl3+FeCl2+4CO2↑(1.5分)
第[三]题(7分)
1.(1)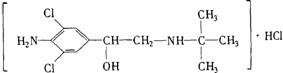 (2.5分) (2.5分)
(2) (1分) (1分)
2.(1)1-(4-羟基苯基)-2[1-甲基-3-(4-羟基苯基)-丙氨基]-乙醇盐酸盐(1.5分)
(2)3 4(各1分)
第[四]题(23分)
1.[Xe]4f145d106s2(1分)
2.(1)PbO2+SO2=PbSO4(1分)
(2)PbS+4H2O2=PbSO4+4H2O(1分)
3.SiO2+CaCO3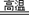 CaSiO3+CO2↑ PbS+2O2 CaSiO3+CO2↑ PbS+2O2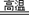 PbSO4 PbSO4
2PbS+3O2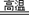 2PbO+2SO2↑ PbO+C 2PbO+2SO2↑ PbO+C Pb+CO↑ Pb+CO↑
PbS+2PbO Pb+SO2↑ PbS+PbSO4 Pb+SO2↑ PbS+PbSO4 2Pb+2SO2↑(各1分) 2Pb+2SO2↑(各1分)
4.Pb+PbO2+4H++2SO42- 2PbSO4+2H2O(1.5分) 2PbSO4+2H2O(1.5分)
5.(1)Pb+2CH3COOH=Pb(CH3COO)2+H2↑(1分)
(2)(CH3CH2)4Pb(1分)
6.Pb2+容易和蛋白质中的含孤对电子的基团如-NH2、-COOH、-SH等形成配位键(即N、O、S提供电子对给铅),一般形成双五元环的铅的螯合物,将铅从人体内排出。(1.5分)
7.(1)根据题意:分解所得混合物中n(Pb2+)=ax mol、n(Pb4+)=a(1-x) mol
根据电子守恒:n(O2)=ax/2 mol、n(Cl2)=a(1-x) mol
y=n(O2)+n(Cl2)=ax/2 mol+a(1-x) mol=a(1-x/2) mol(2.5分)
(2)Pb3O4、PbO 3︰4(各1分)
8.(1)5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
n(PbC2O4)=0.0400×30.25×2.5=3.025 mmol
Pb%=85.39%(2.5分)
(2)PbCrO4-碘量法;EDTA直接滴定(各1分)
第[五]题(8分)
1.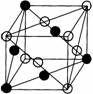 (2分) (2分)
2.设Cu原子半径为r,r= a/4,一个(1,1,1)面上有1/2×3+1/6×3=2个Cu原子。SCu=2πr2=πa2/4,S总= a/4,一个(1,1,1)面上有1/2×3+1/6×3=2个Cu原子。SCu=2πr2=πa2/4,S总=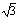 a2/2,SCu/S总= a2/2,SCu/S总=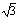 π/6=90.69%。(1.5分) π/6=90.69%。(1.5分)
一个晶胞上有1/2×6+1/8×8=4个Cu原子。SCu=16/3πr3= πa3/6,S总=a3,SCu/S总= πa3/6,S总=a3,SCu/S总= π/6=74.05%。(1分) π/6=74.05%。(1分)
2.阴极面上一层Cu的物质的量为: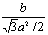 ×2× ×2×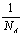 = =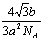 ;沉积的Cu原子的物质的量是: ;沉积的Cu原子的物质的量是: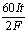 ,层数: ,层数: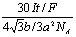 = =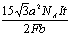 (3.5分) (3.5分)
第[六]题(8分)
1.π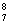 (1分) (1分)
2. (1.5分) (1.5分)
3.a: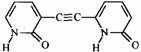 b: b: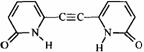 (各1分) (各1分)
4.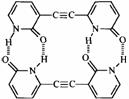 (1.5分) (1.5分)
5.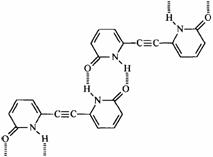  (各1分) (各1分)
第[七]题(8分)
1.A:(2分) B:(1.5分) C:(1.5分)
D:CH3COCH2CH2CH2CHO(1分) E:HOOCCH2CH2CH2COOH(1.5分)
2.5-氧代己醛(0.5分)
第[八]题(7分)
1.MA/0.4760-MA/0.5756=35.45n(1分) MA=97.51n(0.5分)
n=2时MA=195.03n(0.5分) 存在合理Ⅷ族Pt(1分)
2.3Pt+4HNO3+18HCl=3H2PtCl6+4NO↑+8H2O(1.5分)
H2PtCl6+SO2+2H2O=H2PtCl4+H2SO4+2HCl(1.5分)
2.C:(八面体) D:(平面四边形)(各0.5分)
第[九]题(3分)
灼烧后固体为P2Mo24O77,M=3596.5 g/mol(1分)
P的质量分数:(0.5040 g×2×30.97)/(3596.5×0.1030 g)=0.08427(或8.427%)(2分)
下载:
(责任编辑:admin) |
 2.盐酸莱克多巴胺结构式如右:
2.盐酸莱克多巴胺结构式如右:
 2-吡啶酮(结构简式如右)是一种可以与自身互补的分子,在晶体或溶液中,它以氢键连接的二聚体形式存在。若用乙炔基(-C≡C-)将两个2-吡啶酮连接有两种方式:(a)3、6位连接和(b)6,6位连接。Wuest研究了(a)和(b)的聚集行为,在质子溶剂中(a)和(b)都以单体形式存在;在非质子溶剂中(a)以二聚体形式(c)存在,即使浓度很高时,(b)仍以单体形式存在。在本体状态下,(a)形成分散的二聚体(c),(b)形成了平面的线性超分子聚合物(d),(d)有两种典型的空间构型。
2-吡啶酮(结构简式如右)是一种可以与自身互补的分子,在晶体或溶液中,它以氢键连接的二聚体形式存在。若用乙炔基(-C≡C-)将两个2-吡啶酮连接有两种方式:(a)3、6位连接和(b)6,6位连接。Wuest研究了(a)和(b)的聚集行为,在质子溶剂中(a)和(b)都以单体形式存在;在非质子溶剂中(a)以二聚体形式(c)存在,即使浓度很高时,(b)仍以单体形式存在。在本体状态下,(a)形成分散的二聚体(c),(b)形成了平面的线性超分子聚合物(d),(d)有两种典型的空间构型。 磁力搅拌反应8 h后,将得到的褐色混合物倒入丙酮中沉淀,过滤,将得到的褐色沉淀反复用甲醇、丙酮浸泡,洗涤,过滤,然后在60 ℃下真空烘干,得到褐色产物A 0.93 g。已知A是一种在酸性或碱性条件下都易水解的物质。
磁力搅拌反应8 h后,将得到的褐色混合物倒入丙酮中沉淀,过滤,将得到的褐色沉淀反复用甲醇、丙酮浸泡,洗涤,过滤,然后在60 ℃下真空烘干,得到褐色产物A 0.93 g。已知A是一种在酸性或碱性条件下都易水解的物质。 (2.5分)
(2.5分) (1分)
(1分) (2分)
(2分) (1.5分)
(1.5分) b:
b: (各1分)
(各1分) (1.5分)
(1.5分)
 (各1分)
(各1分)