|
高中化学竞赛预赛试卷 山东五莲一中 隽桂才 一、选择题(单选,本题包括12小题,每题3分,共36分) 1.设N0为阿佛加德罗常数,下列对0.2 mol/L硫酸钠溶液的正确说法是( )。 A.1 L溶液中含有0.2 NA个钠离子 B.1 L溶液中含有钠离子和硫酸根离子的总数为0.6 NA C.3 L溶液中钠离子浓度为1.2 mol/L D.2 L溶液中含有0.6 NA个硫酸根离子 2. 下列化合物中键的极性最弱的是( )。 A.FeCl3 B.AlCl3 C.SiCl4 D.PCl5 3. 下列各组离子在溶液中能大量共存的是( )。 A.Fe3+、Na+、Cl-、I- B.Cu2+、K+、NO3-、S2- C.AlO2-、K+、NO3-、OH- D.Ba2+、H+、Cl-、SO42- 4.下列说法正确的是( )。 A.1个碳原子的质量是12 g B.碳元素的原子量是12 g C.碳元素的近似原子量是12 g D.1 mol 12C的质量是12 g 5. 下列反应的离子方程式正确的是( )。 A.亚硫酸钠溶液中加入氢氧化钠溶液: H++OH-=H2O B.用氨水溶解氯化银沉淀: Ag++2 NH3·H2O=[Ag(NH3)2]++2 H2O C.硫酸氢钠溶液中加入碳酸氢钠溶液: H++HCO3-=CO2↑+H2O D.硫化氢气体通入酸性高锰酸钾溶液: 2 MnO4-+5 S2-+16 H+=2 Mn2++5 S↓+8 H2O 6. 下列分子或离子中,构型不为直线型的是( )。 A.I3+ B.I3- C.CS2 D.BeCl2 7. 苯可被臭氧分解,发生如下化学反应:  二甲苯通过上述反应可能的产物为: 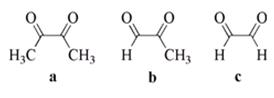 若邻二甲苯进行上述反应,对其反应产物描述正确的是( )。 A.产物为a、b、c,其分子个数比为a:b:c=1:2:3 B.产物为a、b、c,其分子个数比为a:b:c=1:2:1 C.产物为a和c,其分子个数比为a:c=1:2 D.产物为b和c,其分子个数比为b:c=2:1 8. 既易溶于稀氢氧化钠,又易溶于氨水的是( )。 A.Al(OH)3 B.Cu(OH)2 C.Zn(OH)2 D.Ag2O 9. 工业上生产SO2的方法主要是( )。 A.单质硫在空气中燃烧 B.焙烧FeS2 C.亚硫酸盐与盐酸反应 D.浓硫酸与铜反应 10.下列配离子中,还原能力最强的是( )。 A.Fe(H2O)62+ B.Fe(CN)64- C.Co(H2O)62+ D.Co(NH3)62+ 11.化合物M叫假蜜环菌甲素,它是香豆素类天然化合物。对M的性质叙述错误的是( )。 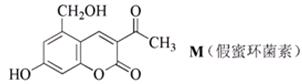 A.1mol M在常压下催化氢化可吸收2 mol H2 B.1 mol M在浓H2SO4存在下可与2 mol CH3COOH反应 C.M可溶于稀NaOH溶液,且加热时发生水解反应 D.1 mol M可与1 mol HBr(氢溴酸)反应 12.下列化合物均为天然萜类化合物: 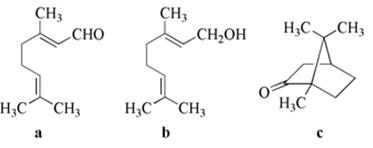 对这些萜类化合物叙述错误的是( )。 A.三种化合物中只有a和c互为同分异构体 B.三种化合物中b的沸点最高 C.三种化合物均易被氧化 D.三种化合物均可催化氢化 二、填空题(本题包括9小题,含18个空,每空2分,共36分) 13. 配平下列反应方程式:□P+□CuSO4+□H2O → □Cu3P+□H3PO4+□H2SO4 。 14. 用电子式表示金属镁与氯气加热形成氯化镁的过程。 。 15. 写出将稀硫酸加入到硫化钠与亚硫酸钠的混合液中,发生反应的离子方程式。 。 16. 有等摩尔浓度的五种溶液: ① CH3COONa、 ② CH3COONH4、 ③ CH3COOH、 ④ NH3·H2O、 ⑤ NH4Cl。 (1)按溶液pH由大到小排列的顺序(写序号)为: 。 (2)按溶液中离子总浓度的大小关系排列顺序(写序号)为: 。 17. 1874年Griess报导了二氨基苯甲酸[C6H3(NH2)2CO2H]脱羧生成二氨基苯[C6H4(NH2)2]的反应。 (1)均称作二氨基苯甲酸的异构体共有 种。 (2)脱羧后能生成邻二氨基苯的二氨基苯甲酸有 种。 (3)脱羧后能生成间二氨基苯的二氨基苯甲酸有 种。 18. 常用的钮扣电池是银锌电池,它分别以锌和氧化银为电极。请写出电池放电时配平的正、负极反应式。 (1)负极: 。 (2)正极: 。 19. 路易斯酸碱电子论的概念是能接受电子对的为酸,能给予电子对的为碱。请判断下列离子或分子中哪些是酸,哪些是碱:H+、F-、OH-、Cu2+、C2O42-、BF3、H2O、SO3。 (1)路易斯酸; 。 (2)路易斯碱: 。 20. 化工行业合成了一种硬度比金刚石还大的晶体氮化碳,其分子式可能是C3N4。该晶体类型为 ,其硬度大于金刚石的主要原因是 。 21. 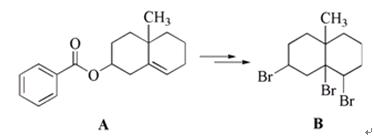 (1)化合物A的分子式为 。 (2)由A转化为B可通过三步反应完成。第一步是将A通过 反应获得中间体X。第二步是X与Br2反应得到另一中间体Y,写出Y的结构简式:Y: 。 第三步是Y与 反应得到产物B。 三、简答题(本题包括7小题,共60分) 22.(6分)将臭氧不断通入酸化的碘化钾淀粉溶液,给出实验现象及相应的反应方程式。 23.(9分)物质A是一种高熔点的化合物,不溶于硫酸、硝酸等强酸。A用纯碱熔融生成化合物B的同时放出无色气体C(标准状态下,密度为1.96 g/L)。若将C通入B的溶液中得到化合物D,D在空气里干燥转化至化合物E,E经加热又可得到A。 (1)化合物A、E的化学式:A: ;E: 。 (2)将C通入B的溶液发生反应的方程式: 。 (3)化合物A能溶于什么酸? 。 溶解反应的方程式为: 。 24.(4分)麻黄碱是一种神经型药物,常用于医治支气管哮喘等疾病。其结构式如下: 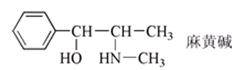 对它的检识方法是:在麻黄碱或其盐的水溶液中加入CuSO4溶液,再加入NaOH溶液,可产生蓝紫色物质P(C20H28N2O2Cu)。写出P的结构。 25.(12分)某配合物[Co(NH3)3(en)(H2O)]Cl2(en:乙二胺) (1)命名: 。 (2)配离子的几何构型为 ;磁性(顺磁或反磁)为 。 (3)图示配离子的几何异构体(不包括旋光异构)。 26.(6分)简要解释为何由不同种元素的原子形成的PCl5分子为非极性分子,而由同种元素的原子形成的O3分子却是极性分子。 27. (16分)碳碳双键有如下的断裂方式: 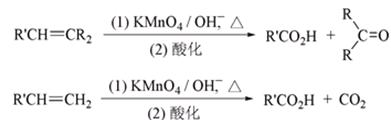 高分子单体A(C6H10O3)可进行如下反应(反应框图): 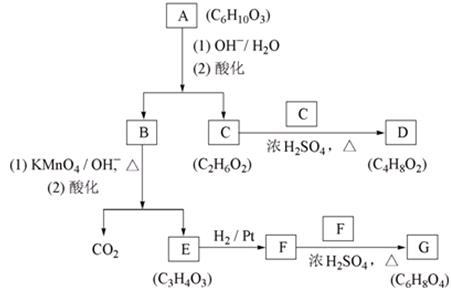 对框图中某些化合物性质说明:室温下A不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na作用放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na作用放出H2。 (1)写出A、C、D、E的结构简式。 A: C: D: E: (2)写出与B所含官能团相同的B的同分异构体: 。 (3)B在浓H2SO4存在下与甲醇反应的产物在一定条件下聚合,写出这个聚合物的结构简式: 。 (4)写出F→G的化学反应方程式: 。 28.(7分)正溴丁烷的制备主要反应如下: 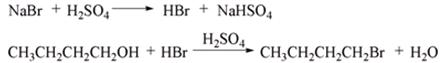 主要实验步骤为:将正丁醇与一定量浓H2SO4和NaBr混合后加热回流,反应一定时间后冷却,对反应混合物进行蒸馏,蒸出粗正溴丁烷和水,用分液漏斗分出粗正溴丁烷,依次用浓H2SO4、水、NaHCO3水溶液、水洗,分出的油层用无水CaCl2干燥后蒸馏得到纯的正溴丁烷。 粗正溴丁烷除含有少量未反应的正丁醇外,还含有少量反应的有机副产物。 (1)写出制备中有机副产物的结构简式: 。 (2)操作中用浓H2SO4洗涤粗正溴丁烷是为了除去 杂质(用文字表述)。 四、计算题(本题包括2小题,共18分) 29.(8分)将SO2和O2的混合气体通入容积为1L的密闭容器内,在一定温度和催化剂存在的条件下,反应达平衡时测得SO2、O2和SO3物质的量分别为2mol、1mol和3mol。 (1)SO2和O2反应的方程式: 。 (2)初始混合气体中:SO2的浓度为 mol/L,其转化率为 ;O2的浓度为 mol/L,其转化率为 。 (3)若将O2的起始浓度增加至6 mol/L,测得相同实验条件下达平衡时SO3物质的量为4 mol,则SO2的转化率为 ;O2的转化率为 。 30.(10分)氮肥或土壤中的含氮量可以用酸碱滴定法测定。称取氮肥氯化铵0.2000 g于蒸馏瓶中,加蒸馏水溶解后加入过量浓NaOH溶液,加热使产生的氨气导入40.00 mL浓度为0.1004 mol/L的硫酸溶液中被吸收。然后用0.1600 mol/L的NaOH标准溶液滴定余量的硫酸,消耗NaOH标液20.11 mL。 (1)写出滴定反应方程式: 。 选用的指示剂是 。 (2)滴定消耗NaOH物质的量为 mmol。 (3)吸收氨消耗的H2SO4物质的量为 mmol。 (4)氮肥试样中氮(相对原子量14)的质量分数为 。 2009级高中化学竞赛预赛标准答案 (本试卷共150分,考试时间120分钟) 一、选择题(单选,本题包括12小题,每题3分,共36分)
二、填空题(本题包括9小题,含18个空,每空2分,共36分) 13. 11、15、24、5、6、15 14.  15. 2 S2-+SO32-+6 H+ = 3 S↓+3 H2O 16. (1) ④ > ① > ② > ⑤ > ③ ;(2) ① = ⑤ > ② > ③ = ④ 17. (1)6;(2)2;(3)3 18. (1)Zn+2 OH--2e = Zn(OH)2 (2)Ag2O+H2O+2e = 2 Ag+2 OH- 19. (1)路易斯酸:H+、Cu2+、SO3、BF3(各0.5分,共2分) (2)路易斯碱:F-、OH-、C2O42-、H2O(各0.5分,共2分) 20. 原子晶体;N原子半径<C原子,即键长C-N<C-C,键能C-N>C-C。 21. (1)C18H22O2; 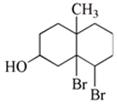 (2)水解; ;HBr 三、简答题(本题包括7小题,共60分) 22. O3氧化I-至I2,使溶液由无色变蓝,颜色由浅至深。 O3+2 I-+2 H+ = I2+O2+H2O) 当O3过量后,I2可被氧化至无色的IO3-,溶液蓝色由深变浅,最后褪至无色。 5 O3+I2+H2O = 2 IO3-+5 O2+2 H+(2分) 23. (1)A:SiO2; E:H2SiO3 (2)CO2+Na2SiO3+2 H2O = H4SiO4↓+Na2CO3 (3)氢氟酸; SiO2+4 HF = SiF4↑+2 H2O 24. 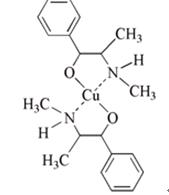 25. (1)二氯化三氨一水一乙二胺合钴(II) (2)八面体; 顺磁 (3)(各3分,共6分) 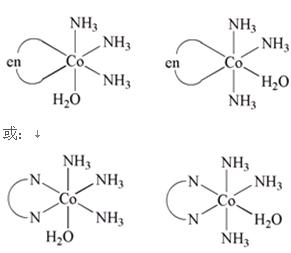 26. PCl5分子是三角双锥形,键的偶极矩相互抵消,使分子的正、负电重心重合,所以PCl5为非极性分子。 O3分子为角形(折线),端氧原子周围电子密度与中心氧原子不同。分子的非对称性及氧原子周围电子密度不同造成正、负电重心不重合,所以O3分子具有极性。 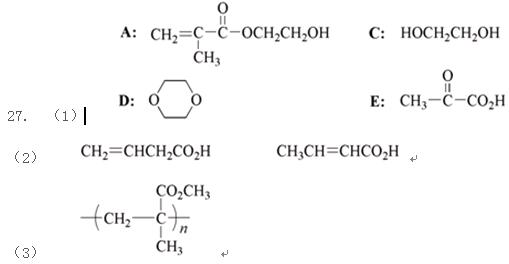  28.(1) CH3CH2CH=CH2;(CH3CH2CH2CH2)2O (2) 正丁醇、正丁醚、1-丁烯 四、计算题(本题包括2小题,共18分) 29. (1) 2SO2(g)+O2(g )  2SO3(g) 2SO3(g)(2) 5; 60%; 2.5; 60% (3) 80%; 33.3% 30. (1)2 NaOH+H2SO4 = Na2SO4 + 2 H2O; 甲基红 (2)3.218; (3)2.407; (4)16.85% 下载: (责任编辑:admin) |
