|
例谈复习中高考化学试题有效“组合”策略 黑龙江省大庆市五十六中学 卢国锋 摘要:高考试题在复习备考中的重要性是不言而喻的,简单的罗列试题是不能达到提升能力的目的,本文尝试从五个角度对试题重组,以实现能力培养目的。 关键词:高考试题组合策略能力 高考试题是能力测验的工具,使用它筛选出接受高校教育的最佳人选,高考试题可以测试多种能力或一种能力的多个层次,本文以考查能力为线索,结合考试说明,采取“借题发挥”,“优化组合”的策略,实现高考试题从“鸡肋”到“盛宴”的华丽转身。 策略一:相似试题组合策略 化学的学习能力考查通常体现在以下四种能力,观察、实验、思维、自学,四者的关系为,观察是入门,实验是手段,思维是核心,自学是方式。多套的历届高考试题进行横向与纵向类比,使学生发现很多问题存在相似或是相近的规律,培养了观察能力,感知题组内在的规律性,洞察考查目的。 例1:(2011?天津)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) 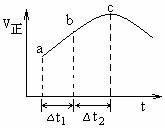 A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点 C.反应物的总能量低于生成物的总能量 D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 例2:(2013?江苏)一定条件下存在反应:CO(g)+H2O(g) A.容器I、II中正反应速率相同 B.容器I、III中反应的平衡常数相同 C.容器I中CO的物质的量比容器II中的多 D.容器I中CO的转化率与容器II中CO2的转化率之和小于1 一个题目的题设情景是由多因素构成的。将这些因素一一分解,便于找出解题的关键。这类能力涉及两个分解,即题设情景的分解和知识块的分解。两道试题都以化学平衡移动为情景,以绝热恒容密闭容器为设问出发点,解决温度对化学平衡的影响问题。 解析例1,很多考生认为C点速率最大,反应达平衡,错选A。化学平衡的实质是v(正)=v(逆)≠0,此反应速率受两个因素影响浓度和温度, 正常v(正)逐渐减小,但该反应v(正)先增大后减小,其原因是反应放热,绝热容器中气体温度升高,v(正)增大,随反应进行反应物浓度减小,v(正)随之减小,但反应仍向正向进行,反应物浓度一直在减小,直至v(正)不变反应才达到平衡。根据下列公式 解析例2,正反应放热,绝热容器中气体温度升高,逆反应吸热,绝热容器中气体温度降低,达到平衡时,容器I温度大于700℃,容器II温度小于700℃,导致A选项,容器I中正反应速率大于容器II中正反应速率。导致B选项有利于容器I平衡向逆反应方向移动,故容器I中CO的物质的量比容器II中的多。导致C选项有利于容器I平衡向逆反应方向移动,有利于容器II平衡向正反应方向移动,故容器I中CO的转化率相应减小,容器II中CO2的转化率同样会相应减小,因此,容器I中CO的转化率与容器II中CO2的转化率之和小于1。恒容绝热的情况下,容器III中温度比容器I高,III中平衡常数小。正确选项( D )。 策略二:试题对比组合策略 对比试题的异同,揭示题与题之间的相同点和不同之处,体验思维方式,提高分析问题能力。高考化学学科所考查的思维能力,既有适于各个不同学科的共同性的能力,也有自己特点的能力,能将化学知识(含实际事物、实验现象、题目指定的各有关数据),按内在联系抽象归纳出规律,并进行推理和想象解决问题。这类能力包括两种重要的科学思维方式,即:归纳思维和演绎思维、正向思维和逆向思维。 例3:(2009?四川)在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) 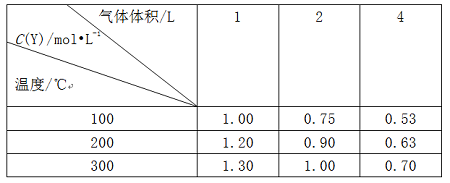 下列说法不正确的是 A.m<n B.Q<0 C.温度不变,压强增大,Y的质量分数减小 D.体积不变,温度升高,平衡向正反应方向移动 例4:(2013?重庆)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 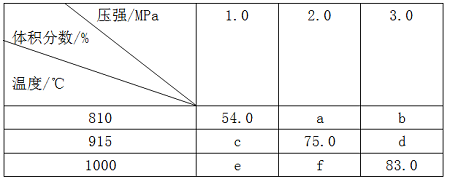 ①b<f ②915℃,2.0MPa时E的转化率为60%③该反应的ΔS>0 ④K(1000℃)>K(810℃) 上述①~④中正确的有 A.4个 B.3个 C.2个 D.1个 解析例3,作为实验测量和计算数据表述主要形式之一的表格,因具有鲜明的定量表达量化信息的功能而被广泛采用。项目栏涉及Y的物质的量浓度与温度、气体体积的关系,借助数据结果逆向思维,推导反应特点。纵向观察表中数据可知,当压强不变时,升高温度,生成物Y的浓度是增大的,说明升高温度平衡向正反应方向移动,则反应是吸热反应,即Q大于0。横向观察表中数据可知,当温度不变,将容积的体积扩大1倍时,如果平衡不移动应该为0.5mol/L、0.6mol/L、0.65mol/L,而平衡后的生成物Y的浓度大于原来的1/2,说明降低压强平衡向正反应方向移动,即m小于n。增大压强平衡向逆反应方向移动,生成物Y的质量分数减小。正确选项(B )。 解析例4,对比例3运用正向思维由反应特点推断实验数据。不要忽略F(s),该反应是一个气体分子数增大的反应,属于熵增反应,所以③正确。横向观察表中数据可知,当温度不变,随着压强增大,平衡逆向移动,G的体积分数减小,判断得54.0>a则a必小于75.0,结合纵行压强2.0 MPa数据,依据温度升高,G的体积分数增大,得出正反应是一个吸热反应结论。吸热反应的化学平常数随温度升高而增大K(1000℃)>K(810℃)。f的温度比b的高,压强比b的小,所以f>b。假设E为1mol,转化率为α 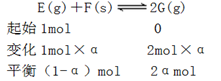 2α/(1+α)=75%,α=60%,正确答案( A )。 策略三:差异试题组合策略 能力构成的三因素,智力因素、知识因素、技能因素。真正形成学科能力,仅有相应的智力是不够的,还必须掌握有关知识和技能。知识从理解的角度看,是懂不懂的问题,技能从运用的角度看,是会不会的问题。高考的能力考查是,基于对已学知识、技能和学习潜能三者结合进行的。同一主题下的不同代表性问题组合,扫描知识盲点,以便及时修复。 例5:设NA为阿伏加德罗常数的值,判断下列叙述是否正确,并说明理由 A.(2013?全国II卷)1.0L1.0mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA( ) B.(2009?安徽)(2013?全国II卷)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。12g石墨烯中含有六元环的个数0.5NA( )  C. (2012?四川) 标准状况下, 33.6 L氟化氢中含有氟原子的数目为1.5NA( ) D.(2013?上海)已知C2H4和C3H6的混合物的质量为ag,则该混合物所含共用电子对数目为(a/7+1)NA( ) E.(2012?江苏) 标准状况下,0. 1 mol Cl2溶于水,转移的电子数目为0. 1NA ( ) F.(2012?四川) 50ml,l8.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA 解析例5,物质的量与化学反应理论、电解质溶液理论、氧化还原与电化学理论、物质结构理论联系紧密。A盲点除NaAlO2中含有氧原子,溶剂水中也含氧原子。B盲点一个六元环中每个碳原子被另外两个六元环共用,通过分摊规律得一个六元环中含碳原子6×1/3=2。C盲点氟化氢因氢键的缘故标准状况下为液体。D盲点共用电子对计算,碳原子有4个未成对电子、氢原子有1个未成对电子,2个未成对电子形成一个共价键,C2H4共价键总数 |
