|
高考反应热问题解法例谈 河北省万全中学 赵铁柱 反应热是研究化学反应中能量变化的重要概念,反应热问题则是高考的重点内容,处理好相关题目的关键是深刻理解概念,掌握解题方法。 一、概念本质剖析 任何化学反应进行过程中都伴随着能量的变化,而这种能量常以热能的形式表现出来,此热能的大小之度量以及反应过程中吸、放热情况都可以用到反应热的概念。 要点:⑴符号:ΔH ⑵单位:kJ/mol。 ⑶判断:ΔH= ∑E(生成物)-∑E(反应物) 其中∑E表示物质具有的总能量。具体地: ①若ΔH>0 ∑E(生成物)> ∑E(反应物),物质所具能量升高,反应吸热。 ②若ΔH<0 ∑E(生成物)< ∑E(反应物),物质所具能量降低,反应放热。 二 、解题方法总结 1.图像分析法  图像的特点是直观、形象,尤其适合问题分析与推断时使用。 例1 (2004年全国)已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为: C(石墨)+O2(g)=CO2(g) △H=-393.51 kJ·mol-1 C(金刚石)+O2(g)=CO2(g) △H=-395.41 kJ·mol-1 据此判断,下列说法中正确的是( )。 A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 解析:根据题意知石墨与金刚石的燃烧都为放热反应,据此作出下图。 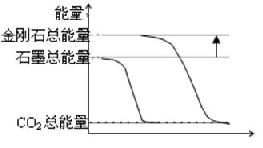 由图很容易看出,金刚石能量比石墨能量要高,即完成由石墨制备金刚石的过程需要吸热。故答案为 A 2.键能计算法 反应热的实质是化学反应中化学键的断裂与形成过程中的能量变化的综合,键能直接反映了化学键的断裂与形成过程中的能量变化,因此反应热与键能有着密切的联系,可以通过键能计算出反应热。 具体地: ΔH=∑E(生成物)-∑E(反应物)=∑U(反应物)-∑U(生成物) 其中∑E表示物质具有的总能量,∑U表示物质所含化学键的总键能。 例2 已知H-H键能为436 KJ/mol,H-N键能为391 KJ/mol,根据热化学方程式 N2(g)+3H2(g)=2NH3(g); ΔH= -92.4KJ/mol,则 N≡N的键能是( ) A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol 解析:ΔH=U(N≡N)+3U(H-H)-6U(N-H)= -92.4 KJ/mol 代入相应数据,计算得E(N≡N)= 945.6 KJ/mol 故选择B 3.定义解析法 燃烧热和中和热是反应热的两个基本概念,它们的考查多围绕定义展开,因此,理解定义内容、抓住定义要点是解题的关键。 ⑴燃烧热定义:在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。 定义要点: ①规定在101 kPa压强下测出热量,因为压强不定,反应热数值不相同。 ②规定以1 mol可燃物作为标准来进行测定,因此在计算燃烧热时,热化学方程式里其他物质的化学计量数常出现分数。 ③规定可燃物完全燃烧生成稳定化合物所放出的热量为标准。 ④燃烧热为放出的热量,故为正值。 ⑵中和热定义:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热。 定义要点: ①必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热。 ②强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)==H2O(l)中和热均为 57.3 kJ?mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ mol-1。 ③以生成1 mol水为基准,测定放出来的热量,因此书写它们的热化学方程式时,应以生成1 mol水为标准来配平其余物质的化学计量数。 例3(2006 天津) 已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g);△H=-221 kJ/mol ②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3 kJ/mol 下列结论正确的是( ) A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 解析:A项考查燃烧热的概念,根据燃烧热的定义要点,结合题给信息,由C(s)到CO(g),CO(g)到CO2(g)的过程均为放热过程,故A正确。 B项考查反应热的概念,反应热要注意正负号,反应①为放热反应,故①的反应热为-221 kJ/mol,故B错误。 C项考查中和热的概念,中和热为放出的热量,为正值,故C错误。 D项要注意醋酸为弱酸,电离时要吸收热量,则最终放出的热量将小于57.3 kJ。 4.盖斯定律法 1840年,俄国化学家盖斯从大量实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。 即化学反应的反应热(能量)只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同,这就是盖斯定律。如:  有:△H1=△H2+△H3+△H4 盖斯定律的主要应用是计算无法直接用实验测量的反应之反应热。 例4 (2006年江苏) 下列各组热化学方程式中,化学反应的△H前者大于后者的是( ) ①C(s)+O2(g)==CO2(g);△H1 C(s)+ O2(g)==CO(g);△H2 ②S(s)+O2(g)==SO2(g);△H3 S(g)+O2(g)==SO2(g);△H4 ③H2(g)+ 1/2O2(g)==H2O(l);△H5 2H2(g)+O2(g)==2H2O(l);△H6 ④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8 A.① B.④ C.②③④ D.①②③ 解析: 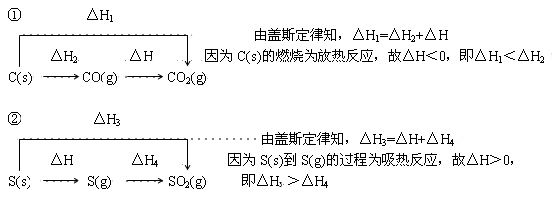 ③根据物质变化与能量变化一一对应的关系,可知发生同样的燃烧反应,物质的量越多,放出的热量越多,则|△H5 |<|△H6|,即△H5>△H6 ④碳酸钙分解吸收热量,ΔH7>0;CaO下H2O反应放出热量,ΔH8<0,显然 ΔH7>ΔH8 故答案为C 此题中的①、②的确定就是根据盖斯定律。 利用盖斯定律解题的关键为:合理设计变化过程。 总之,解决反应热问题的一个基本思路就是抓住定义要点、选择最佳方法,从而以不变应万变,在高考中取胜。 (责任编辑:admin) |
