|
今天高中化学老师给大家整理了高中化学教材20个常考实验总结,一起来学习吧!  一、配制一定物质的量浓度的溶液 以配制100mL1.00mol/L的NaOH溶液为例: 1、步骤:(1)计算(2)称量:4.0g(保留一位小数)(3)溶解(4)转移:待烧杯中溶液冷却至室温后转移(5)洗涤(6)定容:将蒸馏水注入容量瓶,当液面离刻度线1—2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线在同一水平线上(7)摇匀:盖好瓶塞,上下颠倒、摇匀(8)装瓶贴标签:标签上注明药品的名称、浓度。2、所用仪器:(由步骤写仪器) 托盘天平、药匙、烧杯、玻璃棒、(量筒)、100mL容量瓶、胶头滴管 3、注意事项: (1)容量瓶:只有一个刻度线且标有使用温度和量程规格,只能配制瓶上规定容积的溶液。(另外使用温度和量程规格还有滴定管、量筒)  三、焰色反应: 1、步骤:洗—烧—蘸—烧—洗—烧 2、该实验用铂丝或铁丝 3、焰色反应可以是单质,也可以是化合物,是物理性质 4、Na,K的焰色:黄色,紫色(透过蓝色的钴玻璃) 5、某物质作焰色反应,有黄色火焰一定有Na,可能有K 6、命题角度:实验操作步骤及Na,K的焰色 四、Fe(OH)2的制备: 1、实验现象:白色沉淀立即转化灰绿色,最后变成红褐色沉淀。 2、化学方程式为: Fe2++2OH-=Fe(OH)24e(OH)2+O2+2H2O=4e(OH)3 3、注意事项:(1)所用亚铁盐溶液必须是新制的,NaOH溶液必须煮沸,(2)滴定管须插入液以下,(2)往往在液面加一层油膜,如苯或食物油等(以防止氧气的氧化)。 4、命题角度:制备过程中的现象、方程式书写及有关采取措施的原因 五、硅酸的制备: 1、步骤:在试管中加入3—5mL饱和Na2SiO3溶液,滴入1—2滴酚酞溶液,再用胶头滴管逐滴加入稀盐酸,边加边振荡,至溶液颜色变浅并接近消失时停止。 2、现象:有透明的硅酸凝胶形成 3、化学方程式: NaSiO3+2HCl=H2SiO3↓+2NaCl(强酸制弱酸) 4、NaSiO3溶液由于SiO32-水解而显碱性,从而使酚酞试液呈红色。 六、重要离子的检验: 1、Cl-的检验:加入AgNO3溶液,再加入稀硝酸,若生成不溶于稀HNO3的白色沉淀;或先加硝酸化溶液(排除CO32-干扰),再滴加AgNO3溶液,如有白色沉淀生成,则说明有Cl-存在 2、SO42-的检验:先加入盐酸,若有白色沉淀,先进行过滤,在滤液中再加入BaCl2溶液,生成白色沉淀即可证明。若无沉淀,则在溶液中直接滴入BaCl2溶液进行检验。 命题角度:检验方法、除杂、沉淀洗涤及相关纯度的计算 七、氨气的实验室制法 1、反应原理: 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 2、收集:向下排空气法(管口塞一团棉花,避免空气对流) 3、验满:①将湿润的红色石蕊试纸放在试管口,若试纸变蓝,说明氨气已收集满②将蘸有浓盐酸的玻璃棒靠近试管口,出现大量白烟,则证明氨气已收集满 4、干燥方法:碱石灰干燥(不能无水氯化钙) 5、装置图:固体和固体加热制气体的装置,与制氧气的相同  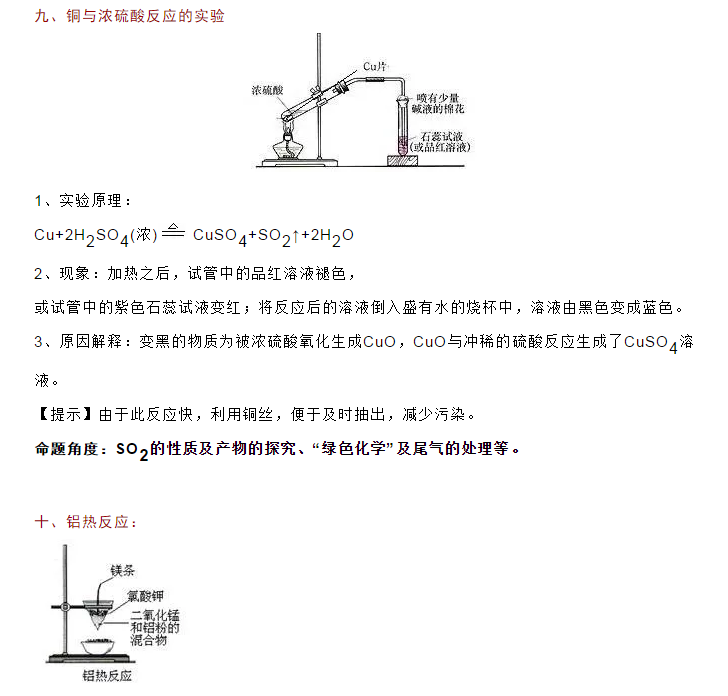  十二、酸碱中和滴定实验(了解): (以一元酸与一元碱中和滴定为例) 1、原理:C酸V酸=C碱V碱 2、要求:①准确测算的体积.②准确判断滴定终点 3、酸式滴定管和碱式滴定管的构造:①0刻度在滴定管的上端,注入液体后,仰视读数数值偏大②使用滴定管时的第一步是查漏③滴定读数时,记录到小数点后两位④滴定时一般用酚酞、甲基橙作指示剂,不用石蕊试液。④酸碱式滴定管不能混用,如酸、具有氧化性的物质一定用酸式滴定管盛装。 4、操作步骤(以0.1molL-1的盐酸滴定未知浓度的氢氧化钠溶液为例) ①查漏、洗涤、润洗 ②装液、赶气泡、调液面、注液(放入锥形瓶中) ③滴定:眼睛注视锥形瓶中溶液中溶液颜色的变化,当滴到最后一滴,溶液颜色发生明显变化且半分钟内部不变色即为滴定终点 5、命题角度:滴定管的结构、读数及中和滴定原理。     十九、醛基的检验(以乙醛为例): A:银镜反应 1、银镜溶液配制方法:在洁净的试管中加入1ml2%的AgNO3溶液(2)然后边振荡试管边逐滴加入2%稀氨水,至最初产生的沉淀恰好溶解为止,制得银氨溶液。 反应方程式: AgNO3+NH3·H2O=AgOH+NH4NO3 AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O 2、银镜实验注意事项:(1)沉淀要恰好溶解(2)银氨溶液随配随用,不可久置 (3)加热过程不能振荡试管(4)试管要洁净 3、做过银镜反应的试管用稀HNO3清洗 B:与新制Cu(OH)2悬浊液反应: 1、Cu(OH)2悬浊液配制方法:在试管里加入10%的NaOH溶液2ml,滴入2%的CuSO4溶液4—6滴,得到新制的氢氧化铜悬浊液 2、注意事项:(1)Cu(OH)2必须是新制的(2)要加热至沸腾(3)实验必须在碱性条件下(NaOH要过量) 二十、蔗糖与淀粉水解及产物的验证: 1、实验步骤:在一支洁净的试管中加入蔗糖溶液,并加入几滴稀硫酸,将试管放在水浴中加热几分钟,然后用稀的NaOH溶液使其呈弱碱性。 2、注意事项:用稀硫酸作催化剂,而酯化反应则是用浓硫酸作催化剂和吸水剂。 在验证水解产物葡萄糖时,须用碱液中和,再进行银镜反应或与新制Cu(OH)2悬浊液的反应。 (责任编辑:admin) |
