|
化学这门学科基础知识相当重要,基础知识只要扎实,再加以做多种变化丰富的题型,就能稳拿高分。今天高中化学老师给高一化学必修第一册2019版,第一章离子反应知识点总结,希望能更好地帮助大家梳理体系。  01.电离:电解质溶于水或受热熔化时解离成自由离子的过程。 酸、碱、盐的水溶液可以导电,说明他们可以电离出自由移动的离子。不仅如此,酸、碱、盐等在熔融状态下也能电离而导电,于是我们依据这个性质把能够在水溶液里或熔融状态下能导电的化合物统称为电解质。 02.电离方程式 H2SO4=2H++SO42- HCl=H++Cl- HNO3=H++NO3- 硫酸在水中电离生成了两个氢离子和一个硫酸根离子;盐酸电离出一个氢离子和一个氯离子;硝酸则电离出一个氢离子和一个硝酸根离子。 【小结】 ①电离时生成的阳离子全部都是氢离子的化合物称为酸。 ②电离时生成的阴离子全部都是氢氧根离子的化合物叫做碱。 ③电离时生成的金属阳离子(或NH4+)和酸根阴离子的化合物叫做盐。 ★书写下列物质的电离方程式:KCl、Na2SO4、AgNO3、BaCl2、NaHSO4、NaHCO3 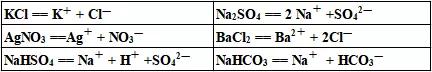  03.电解质与非电解质 ①电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐等。 ②非电解质:在水溶液里和熔融状态下都不导电的化合物,如蔗糖、酒精等。 【小结】 (1)能够导电的物质不一定全是电解质; (2)电解质必须在水溶液里或熔化状态下才能有自由移动的离子; (3)电解质和非电解质都是化合物,单质既不是电解也不是非电解质; (4)溶于水或熔化状态,注意:“或”字; (5)溶于水和熔化状态两种条件只需满足其中之一,溶于水不是指和水反应; (6)化合物、电解质和非电解质,对于不是化合物的物质既不是电解质也不是非电解质。 04.电解质与电解质溶液的区别 电解质是纯净物,电解质溶液是混合物。 无论电解质还是非电解质的导电都是指本身,而不是说只要在水溶液或者是熔化能导电就是电解质。 05.强、弱电解质的对比 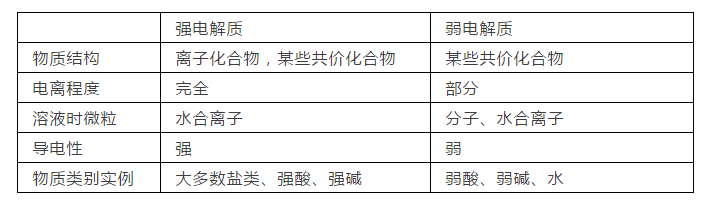 强电解质:在水溶液里全部电离成离子的电解质。 弱电解质:在水溶液里只有一部分分子电离成离子的电解质。 06.离子方程式的书写 ①第一步:写(基础) 写出正确的化学方程式 例如:CuSO4+BaCl2=BaSO4↓+CuCl2 ②第二步:拆(关键) 把易溶、易电离的物质拆成离子形式(难溶、难电离的以及气体等仍用化学式表示) Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl- ③第三步:删(途径) 删去两边不参加反应的离子 Ba2++SO42-=BaSO4↓ ④第四步:查(保证) 检查(质量守恒、电荷守恒) Ba2++SO42-=BaSO4↓ 质量守恒:左——Ba,S,4O|右——Ba,S,4O 电荷守恒:左2+(—2)=0|右0 07.离子共存问题 凡是能发生反应的离子之间或在水溶液中水解相互促进的离子之间不能大量共存(注意不是完全不能共存,而是不能大量共存),一般规律是: 1、凡相互结合生成难溶或微溶性盐的离子(熟记常见的难溶、微溶盐); 2、与H+不能大量共存的离子(生成水或弱)酸及酸式弱酸根离子: 氧族有:OH-、S2-、HS-、SO32-、HSO3- 卤族有:F-、ClO- 碳族有:CH3COO-、CO32-、HCO32-、SiO32- 3、与OH-不能大量共存的离子有: NH42+和HS-、HSO3-、HCO3-等弱酸的酸式酸根离子以及弱碱的简单阳离子(比如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+等等) 4、能相互发生氧化还原反应的离子不能大量共存: 常见还原性较强的离子有:Fe3+、S2-、I-、SO32-。 氧化性较强的离子有:Fe3+、ClO-、MnO4-、Cr2O72-、NO3- 声明: (责任编辑:admin) |
