|
高考网汇集整理《高二化学备考:元素周期表3》 元素周期表—3 教学目标 使学生对同位素及元素相对原子质量的测定有常识性的认识。 教学重点 同位素及元素相对原子质量的测定 教学难点 同位素及元素相对原子质量的测定 教学方法 启发、诱导、阅读、讨论、练习、探究等 教学用具 投影仪、胶片 教学过程 [板书] 第三节 元素周期表(第三课时) [师]前面我们学习了元素周期表的有关知识,知道了门捷列夫在元素周期律的发现及元素周期表的编制过程中,做出了杰出的贡献。那么,引起元素性质周期性变化的本质原因是什么?门捷列夫当时怎样认为的? 引起元素性质周期性变化的本质原因是原子序数的递增,而门捷列夫认为元素的性质是随着相对原子质量的递增而呈周期性变化的。 [师]不但门捷列夫是这样认为的,在他之前的纽兰兹、迈耶尔、德贝莱纳等在探素元素周期律时也是以此为标准的。与他们不同的是:门捷列夫并没有机械地完全相信当时所测定的相对原子质量数值,从而,使元素周期表的编制出现了质的飞跃。 这也说明,相对原子质量的测定在化学发展的历史进程中,具有十分重要的地位。正如我国著名化学家傅鹰先生所说:“没有可靠的原子量,就不可能有可靠的分子式,就不可能了解化学反应的意义,就不可能有门捷列夫的周期表。没有周期表,则现代化学的发展特别是无机化学的发展是不可想象的。” 那么,元素周期表中各元素的相对原子质量是怎样得出来的呢? 元素原子的质量与一种碳原子质量的1/12的比值。 [师]这里的“一种碳原子”指的是哪种碳原子呢? 是原子核内有6个质子和6个中子的一种碳原子,即碳—12原子。 [师]元素周期表中各元素的相对原子质量真的是这样计算出来的吗?要想知道究竟,我们还须了解以下概念。 [板书] 三、同位素 [师]我们以前学过元素的定义,即具有相同核电荷数(或质子数)的同一类原子的总称。也就是说,同种元素原子的原子核中质子数相同。那么,原子核中的中子数是否相同呢?科学研究证明,同种元素原子的原子核中,中子数不一定相同。如氢元素的原子有以下三种: [page] 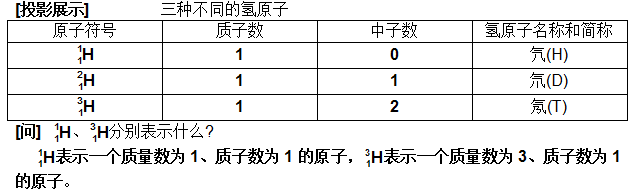   [page]   [page]   (责任编辑:admin) |
