|
(满分100分 时间120分钟)
说明:1. 本试卷分为必做和选做两部分试题。必做题包括必修和化学反应原理模块试题;选做试题只需从所给的三个模块大题中选做二个即可,若都选,则按前二个模块给分。 2. 允许使用计算器。 可能用到的相对原子质量: 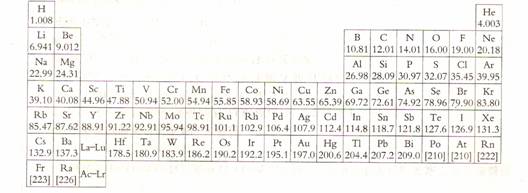 必做试题 (共68分) 一. 选择题(本题包括 16 个小题,每小题2分,共 32 分,每题有 1- 2 个选项符合题意。多选、错选不得分,有两个答案的只选一个且答对者得1分) 1. 最近,“嫦娥一号”月球探测卫星在西昌卫星发射中心由“长征三号甲”运载火箭发射升空。卫星发射后,经过调相轨道段、地月转移轨道段和环月轨道段飞行,已经开始成功执行科学探测任务。“长征三号甲”运载火箭的第一、二级发动机的燃料为偏二甲脐肼 (C2N2H8),四氧化二氮(N2O4)为氧化剂,发生的化学反应是C2N2H8+ 2 N2O4 = 2CO2 + 4H2O + 3N2 + Q (Q>O)。以下说法完全正确的是 ( )。 A. 推动火箭飞行的强大动力源于上述反应产生的气体 B. 火箭燃料燃烧后的氧化产物是N2和H2O C. 火箭起飞后,保险活动门自动开启,排出部分氧化剂 D. 排出的部分高压氧化剂在空气中氧化成红棕色气体 2. 由C60分子聚集成的单质是不导电的绝缘体,但它的金属化合物具有半导体性、超导性。 1991年4 月 Hebard 等首先报道掺钾C60 (KxC60)有超导性,超导临界温度19 K 。在KxC60 的晶体中,C60具有面心立方结构(与NaCl晶体结构中Na+或Cl-的排列方式类似),K+位于其四面体和八面体空隙中,晶胞参数1.4253 nm(相当于NaCl晶胞的边长)。下列说法正确的是 ( )。 A. KxC60 中既有离子键,又有极性共价键 B. C60晶体类型与 KxC60晶体类型分别是分子晶体、离子晶体 C. 占据四面体空隙和八面体空隙中的K+数之比是2 :1 D. x=6 3. 研究发现:塑料经过特殊改造后能够像金属一样具有导电性能。以聚乙炔为例,要使其能导电,必须用I2和Na等作掺杂处理,它们的掺杂过程可用通式表示如下: ①[CH]n + 3x/2I2 → [CH]n x+ + xI3- ②[CH]n + xNa →[CH]n x- +xNa+。其中,用I2掺杂后的聚乙炔结构式如下图  下列说法正确的是( )。 A. 掺杂后的聚乙炔结构中,单双键交替形式不变 B. 掺杂后的聚乙炔之所以能够导电,是因为它是一种盐,成为具有可移动电荷的载体 C. 掺杂反应①中,聚乙炔被还原;掺杂反应②中,聚乙炔被氧化 D. 在掺杂反应①②中,转移电子数都为xe - 4. 超临界流体是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在化学工业上可取代氟利昂等溶剂、发泡剂。下列有关超临界二氧化碳的说法中错误的是( ) 。 A. 超临界二氧化碳是新合成的一种物质 B. 超临界二氧化碳由CO2分子聚集而成 C. 用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去 D. 用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏 5. 某二元酸H2A在水溶液中发生电离:H2A A. 在NaHA 溶液中一定是c(Na+)> c(HA-)> c(OH-)> c(H+) B. 在Na2A溶液中一定是c(Na+)> c(A2-)> c(OH-)> c(H+) C. 在NaHA溶液中c(Na+)+ c(H+) = c(HA-)+2c(A2-) +c(OH-) D. 在H2A溶液中c(H+) = c(HA-)+2c(A2-) +c(OH-) 6. 时钟反应或振荡反应提供了迷人课堂演示实验,,也倍受研究者关注。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤如下: ①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。 ②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。 ③将②中生成的碘完全萃取后,用肼将其还原成I-,化学方程式为: N2H4+2I2 = 4 I-+N2+4H+ ④将生成的I- 萃取到水层后用①法处理。 ⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。 ⑥将①反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,化学方程式为: 2 Na2S2O3+ I2 = Na2S4O6 +2NaI 经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等) 多少倍( )。 A. 2倍 B. 4倍 C. 6倍 D. 36倍 7.“善待地球一科学发展,构建和谐”是“世界地球日”的主题。你认为下列行为中不符合这一主题的是 ( )。 A. 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 B. 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 C. 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 D. 实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生( Recycle) 8. 如下图,分别在两个水槽中盛水和某液体A,再分别滴入一滴苯和水,然后用条型磁铁接近液面,并缓慢移动,水滴跟着移动,而苯滴不移动。则液体A可能为( )。  A. 植物油 B. 乙醇 C. 四氯化碳 D. 苯 9. 为验证物质的浓度对化学反应速率的影响,配制1 mol · L-1的盐酸置于大烧杯中,并取3 mL0.1 mol · L-1的Na2S2O3溶液与3 mL该盐酸反应,产生明显浑浊约需80 s。第二天又用3 mL 0.2 mol · L-1的Na2S2O3溶液与原盐酸3 mL反应,产生浑浊也需80 s 左右(已知:Na2S2O3+2HCl = 2NaCl+S↓+ SO2↑+H2O)。下列关于该实验的评价及结论正确的是( ) A. 浓度对反应速率的影响不大 B. 第二天所用的盐酸浓度较稀 C. 该反应用盐酸表示的速率与用硫代硫酸钠表示的速率数值相等 D. 任何化学反应,反应时间相同,化学反应速率均相同 10. 下列关系图中,A是一种正盐,D相对分子质量比C相对分子质量大16,E是酸,当X 无论是强酸还是强碱时都有如下转化关系 当 X 是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E 均含有另一种元素。下列说法不正确的是( )。 A. D和Z反应生成E不是氧化还原反应 B. 当X是强碱时,E是HNO3 C. 当X是强酸时,E是H2SO4 D. 当X是强酸时,C在常温下是气态单质 11. 科学家对比O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点: ①  ②H─O─O─H。式中O→O表示配位键,即共用电子对由某原子单方面提供(在化学反应中氧氧键遇到还原剂时易断裂)。 化学家Baeyer 和Villiyer为研究H2O2的结构,设计并完成了下列实验: a、将 C2H5OH与浓H2SO4反应,生成(C2H5)2SO4和水; b、将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4; c、将生成的A与H2反应 ( 已知该反应中H2作还原剂)。 下列说法不正确的是 ( )。 A. 用电子式表示①的结构为: B. 用电子式表示②的结构为: C. 假如H2O2的结构如②所示,实验c中反应的化学方程式为:C2H5─O─O─C2H5+ H2 → 2C2H5OH D. 完成实验c就确定了H2O2的精确结构 12. 在 N2O、NO、NO2、N2O3、N2O5五种化合物中,同质量的氮元素结合氧元素的质量比为( )。 A. 1 : 2 : 3 : 4 : 5 B. 2 : 1 : 1 : 2 : 2 C. 1 : 1 : 4 : 3 : 5 D. 1 : 2 : 4 : 3 : 5 13. 某无色溶液,其可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、A1O2-、S2-、CO32-、SO32-、SO42-。现取该溶液进行有关实验,实验结果如下所示:  下列说法正确的是( )。 A. 沉淀甲是S B. 沉淀丙一定是BaCO3 C. 气体甲的成分有4种可能① CO2;② H2S;③SO2;④CO2、H2S D. 综合上述信息,可以肯定存在的离子S2-、SO32-、A1O2-、Na+ 14. 锂电池是近年发展起来的一种新型绿色电池,在通讯、医疗上具有广泛的应用。其电池的总反应式为:8Li+3SOCl2 = 6LiCl + Li2SO3 +2S,则下列说法中不正确的是( )。 A. 负极反应为:8Li-8e - = 8Li+ B. 正极材料可以选用多孔隙的石墨材料 C. 正极反应为:3SOCl2 +8e - = SO32-+2S+6Cl- D. 电池工作时,电流经外电路由负极到正极 15. 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通人CO2的量的关系可表示为( )。  16. 美国劳仑斯国家实验室曾在1999年宣布用86Kr离子轰击208Pb靶得到118号元素的一种原子,其质量数为293。其后,反复实验均未能重现118号元素的信号,因此该实验室在2001 年8月宣布收回该论文。但是科学家们相信,完成的第七周期包含的元素数目与第六周期相同。若118号元素将来被确认,则下列预测合理的是 ( )。 A. 它的最外层电子数是8 B. 它是第八周期元素 C. 它是活泼的金属元素 D. 它的中子数是118 二、非选择题 (本题包括5小题,共36分) 17. (5分) 环境监测测定水中溶解氧的方法是: ①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+ 4OH- = 2MnO(OH)2 (该反应极快) ②测定:开塞后迅速加入1 mL~2 mL 浓硫酸(提供H+,使之生成I2,再用 b mol · L-1的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为: MnO(OH)2 +2I-+4H+ =Mn2++ I2 +3H2O I2+2 S2O32- = 2I- + S4O62- 试回答: (1)滴定 (I2和S2O32-反应) 以淀粉为指示剂,终点时溶液由 色变为 色。 (2)试计算水中溶解氧的量(以g/L为单位),并写出过程。  18. (8分) 甲、乙、丙三种常见的单质,X、Y、Z 三种常见的化合物,它们在一定条件下的相互转化关系如右图所示: 18. (8分) 甲、乙、丙三种常见的单质,X、Y、Z 三种常见的化合物,它们在一定条件下的相互转化关系如右图所示:请填写以下空白: (1)在X、Y、Z 三种化合物中肯定含有乙、丙两种元素的化合物是 。 (2)当 X 为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式 。写出丙跟乙反应的化学方程式 (3)当X为金属元素与非金属元素组成的化合物时,写出 X 跟甲反应的化学方程式 。写出丙跟乙反应的化学方程式 。 19.(6分)家蝇的雌性信息素可用芥酸(来自菜籽油)与羧酸X(摩尔比1 : 1)在浓NaOH溶液中进行阳极氧化脱羧得到。  (1)羧酸X的结构式 。 (2)该合成反应的家蝇雌性信息素理论产率(物质的量分数)是 ,理由是 。 20. (8分) 六价的铬有剧毒,所以要对含Cr(VI)(罗马数字表示元素的价态,下同)废水进行化学处理,最常见的是铁氧磁体法,即把FeSO4 · 7H2O 加入含Cr(VI)的废水中,在pH<4时,Fe2+还原Cr(VI)为Cr(III)。调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III) 、 Cr( III ) 析出组成相当于FeII [FeIIIx· CrIII2-x]4 ( 磁性材料铁氧体的组成)沉淀。试回答: (1) 若废水中,六价铭以Cr2O72-存在。试写出在酸性条件下硫酸亚铁还原Cr2O72-的离子反应方程式并配平: 。 (2) 由 (1) 的结果可确定铁氧磁体中 x= 。 (3) 据 (2) 的结果,若废水中Cr( VI) 按CrO3 计,则加入的FeSO4 · 7H2O与CrO3 的质量比应为多少才能除去废水的Cr( VI) [ 计算m(FeSO4 · 7H2O)/m(CrO3)的值]? 21. (9分) 瑞典皇家科学院2007年10月10 日宣布,德国科学家格哈德·埃特尔因为在表面化学研究领域做出开拓性贡献而获得2007年诺贝尔化学奖。格哈德·埃特尔的研究为现代表面化学提供了科学基础,他的方法不仅被用于学术研究而且被用于化学工业研发。格哈德· 埃特尔对铅催化剂上一氧化碳氧化反应进行研究,这种化学反应主要发生在汽车催化剂中,以消除汽车产生废气所带来的污染。汽车尾气主要含CO2、CO、SO2、NO及烃类物质,这种尾气越来越成为城市污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转化器”。它的特点是使CO与NO反应,生成可参与大气生态循环的无毒气体,并促使烃类物质充分燃烧及SO2的转化。回答下列问题: (1)汽车尾气中NO的主要来源是( )。 A. 烃类物质燃烧产物之一 B. N2和O2发生燃烧反应的产物 C. N2和O2在汽车气缸内电火花条件下化合反应生成的产物 D. 烃与N2 反应的产物 (2)CO 与 NO 反应的化学方程式为: (3)在O2过量的条件下,虽然能使烃完全燃烧,减少污染物CO的生成,但不能有效去除NOx造成的污染。为此人为加入NH3,以与NOx反应生成可参与大气生态循环的无毒物质,化学方程式为: 。 (4)北京2008年奥运会为实现“绿色奥运”承诺,采取的下列措施中符合“绿色奥运”主题的是 ( )。 A. 城市绿化 B. 控制进京人口数量 C. 关停产生污染的工矿企业 D. 限制汽车的销量 E. 改变车用燃料品,推广使用乙醇汽油 (5)有人设想将H2用作汽车发动机的燃料,请你考虑,要实现这一设想,除了要解决H2的制备技术问题外,还要解决一个什么关键问题? 。 选做试题 ( 共32分 ) ( 共三个模块的试题,各16分,同学们只能从中选做2 个模块、共32分的试题。若都选,则按前2个模块给分。) 三、有机化学基础 ( 本题包括2小题,共16分) 1.(10分)在某些酶的催化下,人体内葡萄糖的代谢过程如下:  (1) 过程①、②、③的反应类型分别是:① ② ③ 。 (2) 由质量守恒定律推测,④中的另一种生成物是 (填化学式) 。 (3) 上述五种物质中, 和 互为同分异构体(填A~E序号)。 (4) 葡萄糖是多羟基的醛,写出它与新制氢氧化铜发生反应的化学方程式:___________________。 (5) 在有机物中,若分子中有一个或若干个碳原子以四个单键与四个不同的原子或原子团相连,该有机物就有“对映异构体”。以上A~E物质中有对映异构体的是 (填A~E序号)。  2. (6分) 将固体CaC2O4 · H2O进行热重分析,曲线①表示固体的质量随温度的变化关系,称为热重曲线;曲线②表示化学反应或相变时的热效应,称为差热曲线。 2. (6分) 将固体CaC2O4 · H2O进行热重分析,曲线①表示固体的质量随温度的变化关系,称为热重曲线;曲线②表示化学反应或相变时的热效应,称为差热曲线。(1)试说明下列三个温度区各发生什么变化?并简述理由。 0 ℃~120 ℃: 。 120 ℃~450 ℃ 。 450 ℃~800 ℃ 。 (2)差热分析曲线所显示的峰I、峰II、峰III各代表什么意思? 四、物质结构与性质(本题包括2小题,共16分) 1. (6分) NF3是一种三角锥体分子,键角102 °,沸点-129 ℃;可在铜的催化作用下由F2和过量NH3反应得到。 (1)写出制备 NF3的化学反应方程式: (2)为什么 NF3的键角比NH3的键角(107.3 ℃)小得多? (3)为什么NF3的沸点比NH3的沸点(-33 ℃)低得多? (4)在NF3中N─F键能为280 kJ ·mol,比 BF3 中B─F 键能(646 kJ ·mol)的1/2还小,请解释原因。 2.(10分)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
(1)在周期表中,最可能处于同一族的是 。 A. Q和R B. S和T C. T和U D. R和T E. R和U (2)下列离子的氧化性最弱的是 。 A. S2+ B. R2+ C. T3+ D. U+ (3)T元素最可能是 区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 ,其中心原子的杂化方式为 。 (4)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第 个;试写出U元素的单质与水反应的离子方程式: 。 (5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_______,其中元素 的第一电离能反常高的原因是_________。 五、化学与技术 (本题包括2小题,共16分) 1. (6 分 ) 我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示:  (1) 沉淀池中发生反应的化学方程式是 。 (2) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。 (3) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。 (4) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。 (a) 增大NH4+的浓度,使 NH4Cl更多地析出 (b) 使NaHCO3更多地析出 (c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 2.(10分)材料一 滴滴涕(DDT)是20世纪60 年代前广为应用的一种杀虫剂,它是由三氯乙醛和氯苯通过如下反应制备得到:  据统计,由于使用了DDT等化学农药,减少病虫害,挽回了粮食损失总产量的15 %。……此外DDT还能有效地杀害蚊蝇、体虱等传染疾病的害虫,从而大大减少疟疾、伤寒等发病率和死亡人数。瑞士昆虫学家保罗·米勒因发现DDT药效,而于1948年荣获诺贝尔生理医学奖。 材料二 曾几何时,DDT因其稳定性、脂溶性、药效普适性等特点,而大量生产,普遍使用,以致最终造成环境污染。1962年美国生物学家卡尔松在《寂静的春天》一书中,对包括DDT在内的农药所造成的公害,作过生动的描写“天空无飞鸟,河中元鱼虾,成群鸡鸭牛羊病倒和死亡,果树开花但不能结果,农民们诉说莫名其妙的疾病接踵袭来……”此书问世引起社会强烈反响。从70年代初起,美国、瑞士等国相继禁止生产DDT 。我国政府1985年明令全部禁止使用DDT 。 材料三 DDT从兴起到被取缔,发人深省。为此事,瑞典卡罗琳医学院就因曾颁布诺贝尔奖而表示深深的愧疚。 材料四 为了杀灭对人类有害的昆虫,而又避免或减少污染环境和破坏生态平衡,化学工作者进行了不懈的努力,研制出多种新型杀虫剂,以代替DDT等农药。例如化合物A(如下)就是其中的一种。 请完成下列各题:  (1)氯苯是一种重要的化工原料,由苯和氯气生产氯苯的反应是( ) (1)氯苯是一种重要的化工原料,由苯和氯气生产氯苯的反应是( )A. 化合反应 B. 分解反应 C. 取代反应 D. 加成反应 (2) 下列关于DDT的说法不正确的是 ( ) A. DDT也能杀死有益的生物 B. DDT极易溶于水 C. DDT是烃的衍生物 D. DDT不易被生物分解 (3) 化合物A含有的官能团有 。 (4) 南极企鹅和北极土著居民的体内也曾发现微量的DDT,造成这种情况的主要原因是:__________。 实验又证实,当初美国加利福尼亚州受污染的达莱湖里大鱼体内一类组织中,DDT的浓度竟高达7500 ppm( 百万分之一 ),可毒死食鱼鸟。这类组织是 。 (5) 为避免或减少污染环境和破坏生态平衡,对化学新农药必备的生物化学特性,应作何规定? 。  (责任编辑:admin) |
