|
“冯茹尔”杯2011年江苏省“化学与可持续发展”化学活动周高中化学竞赛试题
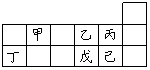
可能用到的相对原子质量:H:1 C:12 N:16 Na:23 Mg:24 Al:27 Cl:35.5 K:39 Ca:40 Fe:56 Cu:64 Ag:108 Ba:137 一、选择题(每小题只有1个选项符合题意。共30小题,每小题1分,共30分。) 1.化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( ). A.广州亚运会燃放的焰火是利用了某些元素的焰色反应 B.加热能杀死流感病毒是因为高温可以使病毒的蛋白质变性 C.凡含有食品添加剂的食物对人体健康均有害,不宜食用 D.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 2.世界环境日宣传“低碳减排绿色生活”,下列做法不符合这一主题的是( ). A.提倡使用一次性筷子 B.利用太阳能和风能等新能源代替化石燃料 C.少乘汽车,多骑自行车 D.改造或淘汰高能耗、高污染产业 3.生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。发生特大火灾时,以下逃生方法最不合适的是( ). A.关紧自家房门,在门上浇水,不让烟火进入屋内 B.向楼顶空旷的地方撤离,寻求消防员\直升飞机救援 C.不论楼层多高,个人身体素质怎样,从阳台或窗口跳出去 D.用湿毛巾捂住口鼻,选择安全楼梯匍匐向下撤离 4.对以下一些说法:①“白雪牌”漂粉精可令所有有色物质黯然失“色”;②霸王洗发液不含任何化学物质;③人喝了啤酒会打嗝,是因为啤酒中的碳酸盐与胃酸反应生成了二氧化碳;④53度白酒是指该白酒的着火点是53℃;⑤太太口服液含丰富的氮、磷、锌等微量元素。你的看法是( ). A.全部正确 B.只有①⑤正确 C.只有③⑤正确 D.都不正确 5.下列叙述错误的是( ). A.维勒用无机物合成了尿素,突破了无机物与有机物的界限 B.门捷列夫在前人工作的基础上发明了元素周期表,表明科学研究既要继承又要创新 C.美国的赫克、日本的根岸英一和铃木章,发明了“钯催化交叉偶联反应”技术,三位科学家共同获得了2010年诺贝尔化学奖 D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的科学 6.下列有关物质聚集态的说法错误的是( ). A.气体没有固定的形状和体积 B.固体、液体不易被压缩,气体易被压缩 C.影响物质的聚集状态的外界因素主要是温度 D.不同聚集状态的物质其内部微粒的运动方式及其微粒间的距离不同 7.你认为下列数据可信的是( ). A.某盐溶液中溶质的质量分数为110% B.某常见气体的密度为1.8g/cm3 C.某澄清石灰水的浓度为2.0mol/L D.某元素的原子半径是0.160nm 8.坩埚是实验室用于灼烧或熔融固体物质的常用仪器,材质种类很多。熔融烧碱时可以选用( ). A.普通玻璃坩埚 B.石英坩埚 C.陶瓷坩埚 D.铁坩埚 9.Al2H6的球棍模型如右图所示,它的熔点为150℃,燃烧热极高。下列说法肯定错误的是( ). 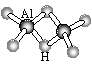 A.Al2H6中H为-1价,Al为+3价 B.Al2H6在空气中完全燃烧,产物为氧化铝和水 C.Al2H6是离子化合物 D.Al2H6可能成为未来的储氢材料和火箭燃料 10.二氧化氯(ClO2)是一种高效消毒剂,下列反应可制得ClO2:2NaClO3+Na2SO3+H2SO4= 2ClO2+2Na2SO4+H2O。对于该反应,下列说法正确的是( ). A.硫元素化合价升高 B.是复分解反应 C.H2SO4发生氧化反应 D.NaClO3是还原剂 11.下列对实验现象的分析合理的是( ). A.氯气使湿润的有色布条褪色,说明氯气具有漂白性 B.某溶液能使酚酞溶液变红,可证明该溶液一定是碱溶液 C.向酸性高锰酸钾溶液中通入二氧化硫,溶液褪色,说明SO2具有还原性 D.某物质焰色呈紫色,说明其一定是钾盐 12.对下列事实的解释错误的是( ). A.蔗糖遇浓硫酸会变黑,因为浓硫酸具有脱水性 B.浓硝酸在光照下变黄,因为浓硝酸不稳定 C.浓硝酸可以用铝槽贮存,因为铝与浓硝酸不反应 D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸 13.实验室有一瓶购置时间较长的绿矾(FeSO4·7H2O),老师请某同学检验其是否变质,这位同学取绿矾做了简单实验,得出的结论是:已部分氧化变质。该同学所用的试剂和判断依据是( ).
14.若工业炼铜分别采用下列方法,其中不恰当的是( ) A.矿堆浸铜 B.生物炼铜 C.电解精炼 D.氢气还原 15.下列方法符合实际并用于工业生产的是( ) A.CO2通入氢氧化钠溶液中制Na2CO3 B.H2和Cl2光照制HCl C.Cl2通入澄清石灰水中制漂白粉 D.用硫磺制硫酸 16.下列有关物质性质或应用的说法正确的是( ) A.工业上分别用电解MgO和Al2O3的方法制备镁和铝 B.单质硅是将太阳能转变为电能的常用材料 C.自来水厂常用NaClO净化、消毒原水 D.实验室可用裂化汽油萃取溴水中的溴 17.下列有关“从铝矾土中提取纯度较高的氧化铝的工艺流程”说法符合实际的是( ) ①将铝土矿用稀硫酸溶解,过滤去除二氧化硅;②向酸性滤液中加入过量烧碱溶液过滤去除氢氧化铁;③将粉碎后的铝土矿投入烧碱溶液中,过滤去掉残渣;④向碱性滤液中通入过量二氧化碳气体,过滤得沉淀;⑤灼烧用二氧化碳酸化所得之沉淀。 A.①②⑤ B.③④⑤ C.①④⑤ D.③②⑤ 18.下列除杂质的操作中不正确的是( ) A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤 B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤 C.Na2CO3固体中混有少量NaHCO3:加适量NaOH溶液 D.Al(OH)3中混有Mg(OH)2:加入足量烧碱溶液后过滤,向滤液中通入过量CO2后过滤 19.月球的矿产资源极为丰富,仅月球表层5cm厚的沙土就含铁单质上亿吨,月球上的主要矿物有辉石[CaMgSi2O5]、斜长石[KAlSi3O8]和橄榄石[(Mg,Fe)2SiO4]等,下列说法不正确的是( ) A.辉石、斜长石和橄榄石均属于硅酸盐 B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2 C.橄榄石中Fe为+2价 D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱 20.用NA表示阿伏伽德罗常数的值,下列说法正确的是( ) A.1.0 L 1.0 mol·L-1 CH3COOH溶液中含H+数为NA B.1 mol Na2O2与足量H2O充分反应,转移电子数为2NA C.标准状况下,2.24 L N2中含有的共用电子对数约为0.1NA D.常温常压下,21 g氧气和27g臭氧所含氧原子总数为3NA 21.不具有放射性的同位素称为稳定同位素,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是( ) A.34S原子核内中子数为16 B.1H216O在相同条件下比1H218O更易蒸发 C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强 22.NO2-既有氧化性,又有还原性。NaNO2大量进入血液时,能将血红蛋白中的Fe2+氧化成Fe3+,正常的血红蛋白转化为高价血红蛋白,失去携氧功能,引起中毒,甚至死亡。下列各组试剂不能检验NO2-的是( ) A.FeCl2和KSCN B.BaCl2和HNO3 C.KMnO4和H2SO4 D.KI和淀粉 23.下列现象或事实解释正确的是( ) A.“雷雨发庄稼”,因为雷电可引发氮气与氧气的化合反应 B.铝热反应需要一定的能量引发,因为铝热反应为吸热反应 C.增加炼铁高炉的高度能提高CO的转化率,因为化学反应更充分了 D.鸡蛋清中加入2滴1%醋酸铅溶液后产生沉淀,因为蛋白质发生了盐析 24.下列说法正确的是( ) A.2mol·L-1 KCl溶液与1mol·L-1 K2SO4溶液混合后c(K+)为2mol·L-1 B.120g NaCl溶液中溶有20gNaCl,该温度下NaCl的溶解度为20g C.22.4L HCl气体溶于水制成1L溶液,该溶液的物质的量浓度为1mol·L-1 D.把5g胆矾溶于45g水中,所得溶液溶质的质量分数为10% 25.右表为元素周期表短周期的一部分。下列有关甲、乙、丙、丁、戊、己六种元素的叙述正确的是( )
A.甲原子半径小于丙原子半径 B.乙元素原子的核电荷数和中子数一定都为6 C.丙的氢化物稳定性大于己的氢化物稳定性 D.最高价氧化物的水化物酸性丁大于戊 26.下列各组离子在指定环境中一定能大量共存的是( ) A.使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- B.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ C.pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- D.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- 27.下列离子方程式与所述的事实相符且正确的是( ) A.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++SCN-=Fe(SCN)3↓ B.用双氧水和稀硫酸可以雕刻印刷电路板:Cu+H2O2+2H+=Cu2++2H2O C.向偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- D.向碳酸氢钙溶液中加入足量的氢氧化钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O 28.氢气是一种理想的能源,如何获得氢气一直是人类追寻的目标。1996年,范克等人提出用H2O、SO2和I2为原料进行热化学循环制氢法:2H2O(l)+SO2(g)+I2(s)  H2SO4(aq)+ 2HI(g);H2SO4(aq) H2SO4(aq)+ 2HI(g);H2SO4(aq) H2O(l)+SO2(g)+O2(g);2HI(g) H2O(l)+SO2(g)+O2(g);2HI(g) H2(g)+I2(g)。从理论上讲,该循环中,amol原料水能制得氢气( ) H2(g)+I2(g)。从理论上讲,该循环中,amol原料水能制得氢气( )A.amol B.0.5amol C.0.25amol D.2amol 29.某工厂排放的废水中含有硫酸,原来采用氢氧化钠溶液处理,通过调节流量阀,使最终排出的溶液呈中性(如右图)。现改用氢氧化钾溶液处理并得到钾肥,若氢氧化钾溶液中溶质质量分数与原来所用氢氧化钠溶液溶质质量分数相同(假设两种碱溶液的密度相同),在废水流量不变的情况下,碱的流量阀应作的调节为( ) 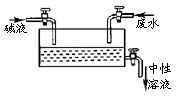 A.保持不变 B.加大流量 C.减小流量 D.无法确定 30.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )  A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊 C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 D.若A为浓硝酸,B为铜屑,C中盛NaOH溶液,则D中无红棕色气体 二、选择题(每小题有1~2个选项符合题意。共20小题,每小题2分,共40分。)
A.化冰盐和冰雪反应放出热量使冰雪融化 B.氯化镁的电子式为Mg2+[:Cl:]2- C.化冰盐也可以食用 D.大量使用“化冰盐”会污染环境 32.科学家正在研究一种新能源——盐能。当海水与淡水混合时,温度将会升高,世界每天所有入海口的这种能源相当于电力需求的20%。海水与淡水混合时,温度升高最可能的原因是( ) A.发生了复分解反应 B.发生了水分解反应 C.由于浓度差产生放热 D.盐的溶解度增大 33.没有必要通过具体实验进行探究的是( ) A.探究SO2和Na2O2反应可能有Na2SO4生成 B.探究Na与水反应可能有O2生成 C.探究浓硫酸与铜在一定条件下反应得到的黑色物质中可能有CuS D.探究Cl2通入滴有酚酞的NaOH溶液中红色褪去是酸碱性变化还是ClO-的漂白 34.下列实验操作不可行的是( ) A.用激光笔检验鸡蛋清溶液和葡萄糖溶液 B.浑浊的高锰酸钾溶液用普通漏斗加滤纸过滤 C.用量筒、玻璃棒、烧杯和浓硝酸配制大约3mol·L-1硝酸200mL D.用U形管、铁钉、石墨棒、干电池、鳄鱼夹和导线电解少量食盐水 35.资料表明,当压强达到22Mpa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,称之为“水热反应”。生物质在底下高温高压条件下通过水热反应可生成石油、煤等矿物。下列说法不正确的是( ) A.“水热反应”是一种复杂的物理变化 B.水热反应对研究如何吸收利用CO2很有意义 C.随着科技进步,利用“水热反应”有望实现地球上碳资源的循环 D.生物质与超临界水作用生成汽油的反应,能解决目前人类汽油短缺问题 36.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;③将得到的产物熔融电解得到镁。下列说法错误的是( ) A.此法的优点之一是原料来源丰富 B.①②③步骤的目的是从海水中提取MgCl2 C.以上提取镁的过程中涉及化合、分解和复分解反应 D.第①到第④步的反应中,分解反应都是氧化还原反应 37.潜艇上的核反应堆内常使用液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( ) A.原子半径:Na<Al B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀,也可能有铜析出 D.mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小 38.科学家将液态的金属镓(Ga)充入碳纳米管,发明出一种世界上最小的温度计——碳纳米管温度计。该温度计通过电子显微镜进行读数,精确度较高,其测量范围在10~490℃。下列说法错误的是( ) A.常温常压下镓为液体 B.金属镓的体积在10~490℃之间随温度的变化比较均匀 C.碳纳米管的体积在10~490℃之间随温度的变化很小,可忽略不计 D.镓与铝同主族但原子序数大于铝,Al(OH)3、Ga(OH)3均是两性氢氧化物 39.1934年居里夫妇用α粒子轰击2718Al得到一种自然界不存在的核素3015P,开创了人造核素的先河。其发生的变化可表示如下: 2713Al+42He→3015P+10n。下列有关说法错误的是( ) A.3015P和3115P两种核素互为同位素 B.在3015P中,质子数=中子数=核外电子数 C.该变化说明原子在化学变化中也能发生变化 D.该变化同样遵循质量守恒定律 40.在一定浓度的BaCl2溶液中通SO2气体,未见沉淀生成;若先通入另一种气体,再通入SO2,则可生成白色沉淀,另一种气体是( ) A.Cl2 B.HCl C.NH3 D.CO2 41.下列变化中的氧化剂和还原剂不是同一物质的是( ) A.过氧化钠吸收二氧化碳生成碳酸钠和氧气 B.氯气与石灰乳作用生成次氯酸钙和氯化钙 C.二氧化锰和浓盐酸受热生成氯气、氯化锰和水 D.高锰酸钾受热分解生成氧气、锰酸钾和二氧化锰 42.某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是( )  A.钠着火燃烧产生苍白色火焰 B.反应生成的大量白烟是氯化钠晶体 C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气 D.根据管右端棉球颜色变化可判断氯气是否被碱液完全吸收 43.某学生设计了如图的方法对A盐进行鉴定。由此分析,下列结论中正确的是( ) 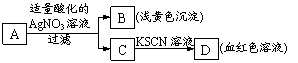 A.A中一定有Fe3+ B.A可能为FeBr2溶液 C.C中一定有Fe3+ D.B为AgI沉淀 44.下列叙述正确的是( ) A.Na2O2晶体中含有的阳离子数和阴离子数相等 B.任意比例的碳酸钙和碳酸氢钾的混合物中氧的含量都是一样的 C.1molCH4与1molSiO2中含有的共价键数相同 D.3.08g 2CaSO4·H2O晶体中含有的水分子数为0.02NA个 45.X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同。下列说法正确的是(选项中m、n均为正整数)( ) A.若X(OH)n为强碱,则Y(OH)n也一定为强碱 B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 C.若X元素形成的单质是X2,则Y元素形成的单质不一定是Y2 D.若Y的最高正价为+m,则X的最高正价一定为+m 46.Na3N是离子化合物,它与水作用产生NH3。下列叙述正确的是( ) A.Na3N与盐酸反应可产生两种盐 B.在Na3N与水反应中,Na3N作还原剂 C.Na+与N3-电子层结构与氩原子相同 D.Na+半径比N3-半径小 47.由下列事实所得出的相应结论正确的是( )
48.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是( ) ①过量的锌与18mol·L-1硫酸溶液;②过量的氢气与少量的N2在催化剂存在下;③浓盐酸与过量的MnO2;④过量的铜与浓硫酸;⑤过量的稀盐酸与块状石灰石;⑥过量银与稀硝酸。 A.②③④ B.②③⑤ C.①④⑤ D.①②③④⑤ 49.混合下列各组物质使之充分反应,加热蒸干产物并在300℃(低于各物质的分解温度)灼烧至质量不变,最终残留固体为纯净物的是( ) A.向亚硫酸钠溶液中滴加过量的溴水 B.将物质的量浓度相等的KAl(SO4)2与Ba(OH)2溶液以体积比1:2混合 C.等体积、等物质的量浓度的碳酸钠与氢氧化钡溶液混合 D.在NaBr溶液中通入过量氯气 50.某澄清溶液中存在Na+、NH4+、Fe2+、I-、Br-、CO32-、SO32-七种离子中的几种。将该溶液进行如下实验:①滴加足量的新制氯水,有气泡生成,溶液变黄色;②向“①”中所得溶液中加入BaCl2溶液,无沉淀生成;③向“①”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液( ) A.一定存在Na+ B.可能存在NH4+ C.一定不存在I-、SO32- D.一定存在Fe2+、Br-、CO32- 三、选择题(每小题有1~2个选项符合题意。共10小题,每小题3分,共30分。) 51.铁氧磁体法处理含Cr2O72-的废水的原理可概述为:向Cr2O72-的酸性废水中加入FeSO4·7H2O,将Cr2O72-还原为Cr3+,调节溶液的pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢx·CrⅢ2-x]O4(铁氧磁体,罗马数字表示元素的价态)的沉淀。处理含1mol Cr2O72-的废水至少需要加入amolFeSO4·7H2O。下列结论正确的是( ) A.x=0.5,a=8 B.x=0.5,a=10 C.x=1.5,a=8 D.x=1.5,a=10 52.右图是某燃煤发电厂处理废气的装置示意图。下列说法正确的是( ) 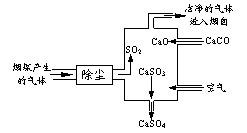 A.此过程中没有分解反应 B.整个过程的反应可表示为: 2SO2+2CaCO3+O2=2CaSO4+CO2 C.使用此废气处理装置可减少CO2的排放 D.此过程中S元素的化合价未发生改变 53.现有100mL溶质为MgCl2和AlCl3的混合溶液,其中c(Cl-)=1.0mol·L-1,c(Mg2+)= 0.2mol·L-1。若不考虑水解因素,要使其中的Mg2+全部转化为Mg(OH)2沉淀分离出来,至少需要4mol·L-1的NaOH溶液的体积是( ) A.25mL B.5mL C.30mL D.100mL 54.在NaIO3的碱性溶液中通入氯气,可以得到Na2H3IO6。下列有关该反应的说法错误的是( ) A.在该反应中NaIO3作还原剂 B.碱性条件下,Na2H3IO6,氧化性强于氯气 C.反应中生成1molNa2H3IO6,转移2mol电子 D.反应中氧化产物与还原产物的物质的量之比为1:2 55.由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右下图转化关系(部分生成物和反应条件略去)。下列推算错误的是( ) A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是Na+[:O:O:]2-Na+ D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐 56.由5molFe2O3、4molFe3O4和3molFeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的物质的量之比可能是( ) A.4:3 B.3:2 C.3:1 D.2:1 57.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取3份100mL溶液进行如下实验:①第1份加入AgNO3溶液有沉淀产生;②第2份加入足量NaOH溶液加热后,收集到气体0.04mol;③第3份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,下列推测不正确的是( ) A.Cl-可能存在 B.每份溶液中含0.01molCO32- C.K+一定存在 D.Ba2+、Mg2+都可能存在 58.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中铜的质量分数为a,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( ) A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 B.若金属全部溶解,则溶液中一定含有Fe3+ C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) 59.0.035mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是( ) A.30 B.42 C.45 D.60 60.某同学做金属钼(Mo)在氧气中燃烧的实验测其氧化物的组成,结果如图所示,该同学利用实验结果得出Mo的氧化物Ⅰ和Ⅱ分别为( ) 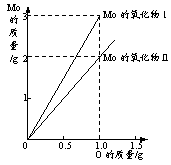 A.Ⅰ为MoO3,Ⅱ为Mo2O B.Ⅰ为MoO,Ⅱ为MoO2 C.Ⅰ为MoO3,Ⅱ为MoO2 D.Ⅰ为MoO2,Ⅱ为MoO3 下载: (责任编辑:admin) |