|
氧化还原反应有关计算中的守恒与方法 河北省宣化县第一中学 栾春武 一、守恒 “守恒”是化学中的一个永恒规律,在氧化还原反应中常涉及的守恒有: (1)电子守恒: 电子守恒是指氧化剂得到的物质的量(或个数)和还原剂失去电子的物质的量(或个数)相等,即反应前后氧化剂得到电子的总数等于还原剂失去电子的总数。 (2)质量守恒; 质量守恒是指氧化还原反应中反应前后各元素的种类和相应的原子个数不变。 (3)电荷守恒 电荷守恒是指在离子反应中,所有阳离子所带正电荷总数等于所有阴离子所带的负电荷总数,即溶液呈电中性。 二、方法 对氧化还原反应的有关计算应根据化合价的变化,理清氧化和还原两条线索,以得失电子守恒为切入点,并结合化学方程式和质量守恒列式求解。 对于过程相对复杂的氧化还原反应,(连续反应或多个反应并列发生)的计算,可以通过分析反应前后,始终两态涉及的所有物质,找出所有起始物质到终了物质中化合价发生变化的元素,根据化合价升高总数和化合价降低总数相等列式求解,简化解题步骤。 【例题1】在一定条件下的硝酸铵受热分解的未配平的化学方程式为( ) NH4NO3 A. 5 : 3 B. 5 : 4 C. 1 : 1 D. 3 : 5 解析:分析题意,根据化合价概念,被氧化与被还原的分别是NH4NO3中的NH4+中的N原子和NO3-中的氮原子,设被氧化的N原子数为x,则失去电子为3x,设被还原的N原子数为y,则得到电子为5y,那么3x = 5y,x : y = 5 : 3 答案:A 【例题2】12 mL浓度为0.1 mol//L的Na2SO3溶液,恰好与10 mL浓度为0.04 mol//L的K2Cr2O7溶液,完全反应,通过计算确定Cr元素在还原产物中的化合价。 解析:在Na2SO3溶液与K2Cr2O7溶液发生的氧化还原反应中,Na2SO3充当还原剂,1 mol Na2SO3失2 mol电子,K2Cr2O7充当氧化剂得到电子,两者得失电子的物质的量相等,即:12×10-3 L×0.1 mol//L×2 = 10×10-3 L×0.04 mol//L×2×(6-x),解得:x = +3价。 答案:+3 【例题3】(09年全国卷Ⅱ B.x=0.6a,2Br-+ Cl2 = Br2+2Cl- 2Fe2+ + Cl2 2Fe3+ + 2Cl-,2Br- + Cl2 2FeBr2 + 3Cl2 当x/a≥1.5时,Fe2+ 和Br-全部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+ 全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错误。 【例题4】5.12 g Cu和一定质量的浓硝酸反应,当Cu反应完时,共收集到标准状况下的气体3.36 L,若把装有这些气体的集气瓶倒立在盛水的水槽中,需通入多少升标准状况下的氧气才能使集气瓶充满溶液? 解析:铜失去电子的物质的量 = 被还原的硝酸得到电子的物质的量 = 氧化还原产物NO、NO2消耗的氧气的电子的物质的量,省去中间计算过程,即可简化为:铜失去电子的物质的量 = 氧气得电子的物质的量。 则有:n(Cu)×2 = n(O2)×4 n(O2) =5.12 g/64 g·mol-1×2× = 0.04 mol V(O2) = 0.04 mo×22.4L/mol = 0.896 L 若用常规方法,应先求出NO、NO2物质的量,再根据: 4NO2 + O2 + 2H2O === 4HNO3,4NO + 3O2 + 2H2O === 4HNO3 计算出氧气的量,并求出其体积,此方法运算量大,计算步骤多且容易出错,用电子守恒法能使计算过程大大简化。 答案:0.896 L 【例题5】15 g 镁铁合金,溶解在一定量的某浓度的稀硝酸中,当金属完全反应后,收集到标准状况下5.6 L NO气体(假设硝酸的还原产物只有NO),在反应后的溶液中加入足量的氢氧化钠溶液,可得多少克沉淀? 解析:该反应中铁的价态无法确定,若用常规解法需要进行讨论,但Mg、Fe失去电子的物质的量等于氮(N)元素得到电子的物质的量。 n(得)=n(失)=5.6 L/22.4 L·mol-1×3 = 0.75 mol Mg、Fe失去电子后,对应的阳离子所带的正电荷共为0.75 mol,它也等于沉淀生成的阳离子所需OH-的物质的量,即n(OH-) = 0.75 mol. m(沉淀) = m (阳) + m(OH-) = 15 g + 0.75 mol×17 g/mol = 27.75 g 答案:27.75 g
解析:(1)分析化合价知:AsH3 → H3AsO4,元素的化合价升高,所以AsH3为还原剂。(2)设X中Br的化合价为x,则: 0.2 mol×(5-x) = 1 mol,解得:x = 0,所以X为Br2 (3)在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,选a、c。 (4) 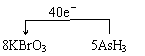 (责任编辑:admin)
(责任编辑:admin) |
