|
例谈化学题中隐蔽条件的挖掘 广东省惠来慈云实验中学 刘 宇 化学题的解答离不开对已知条件的分析与应用。但是不少化学题目的已知条件(或部分已知条件)隐蔽在题目的叙述中,稍不注意就被忽视,使得解题陷入困境甚至误入歧途,因此必须对此加以重视。下面通过典型例题介绍几种挖掘隐蔽条件的方法。 1. 根据化学实验的操作要领挖掘隐蔽条件 化学实验在具体的操作过程中都有着各自不同的操作要领,在学习、实验的过程中我们加以深刻的理解,对正确解题起着至关重要的作用。 例1 实验室需用480 mL0.1 mol·Lˉ的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( ) A.称取7.68 g硫酸铜,放入500 mL水中 B.称取12.0 g胆矾配成500 mL溶液 C.称取8.0 g硫酸铜,放入500 mL水中 D.称取12.5 g胆矾配成500 mL溶液 解析:在选择之前,我们首先得回顾实验,配制溶液的第一步是依据所配溶液的体积选择合适的容量瓶(本题为500 mL),所以在计算的时候应当选择用500 mL来进行计算,同时还得注意两个问题:⑴区分硫酸铜和胆矾;⑵精确配制溶液时体积为配出溶液的体积而非配溶液前水的体积。 答案:D 例2 实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )。
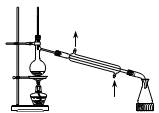 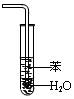 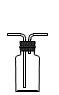 ① ② ③ ④ A.装置①常用于分离互不相溶液体混合物 B.装置②可用于吸收HCl气体,并防止倒吸 C.向FeSO4溶液中滴加NaOH溶液制取Fe(OH)2 D.装置④b口进气可收集CO2、NO等气体 解析:对于C选项,虽说将滴定管伸入试管是不规范的操作,但是为了防止NaOH溶液在滴落过程中混入氧气导致产物的氧化,我们将实验进行了改进,属正确操作。 答案:C 2. 精析化学反应原理发掘隐蔽条件 化学反应的发生,都有着其反应的原理,如:氧化性强的制出氧化性弱的、强酸制出弱酸等等,我们只有在分析清楚该反应的原理后方能得出正确的结论。 例3 在氧化还原反应3Fe + 8HNO3 == 3Fe(NO3)2 + 2NO↑+ 4H2O中,以下对该反应的描述错误的是( )。 A.Fe作氧化剂,HNO3作还原剂 B.有2 mol HNO3被还原时只有2 mol Fe被氧化 C.有2 mol HNO3被还原时有3mol Fe被氧化 D.产物是Fe(NO3)2,所以HNO3只有弱氧化性 解析:我们知道,HNO3不论其浓度是多大,都具有强氧化性,均能将Fe氧化成Fe3+,但方程式中不是Fe3+而是Fe2+,并非HNO3的氧化性问题,而是在铁粉过量的情况下,过量的铁粉将之前生产的Fe3+还原成Fe2+,反应包括了两个过程:Fe + 4HNO3 == Fe(NO3)3+ NO↑+ 2H2O, Fe + 2Fe(NO3)3 == 3Fe(NO3)2,题干中的方程式实则总反应方程式。从分步反应中很容易的出正确的结论。 答案:C、D 例4 下表是几种物质在指定温度下的溶解度(g)。现将相同物质的量的NaCl、CO2、NH3 在30℃时制成溶液,此时溶液中无晶体,当降温至某温度时,开始析出晶体,此晶体是( )。
A.NH4Cl B.NH4HCO3 C.NaHCO3 D.NaCl 解析:该题目咋一看无从下手,但是我们结合答案发现:不论选哪个答案,都说明在析出晶体前发生了化学反应,而且该反应是一溶液中的复分解反应。从反应的原理我们知道,反应是向着溶液中离子总浓度下降的方向,也即向着生成溶解度最小的物质。从表中每相同温度下的溶解度进行比较,即可得出答案。 答案:C 3. 联系概念、定义发掘隐蔽条件 在化学的理论学习中,也存在很多的概念、定义,如:中和热、燃烧热、溶解度等等。我们必须认真的分析、深入的理解概念包含的内容和其中的隐蔽条件。 例5 有热化学反应H2 SO4 (aq)+2 NaOH (aq)==== Na2SO4 (aq) + 2H2O;△H=-114.6 kJ/mol。中和热为( ) A.-57.3 kJ/mol B.57.3 kJ/mol C.-114.6 kJ/mol D.114.6 kJ/mol 解析:中和热是指发生酸碱中和反应生成1mol水时释放出的能量,对于定义,我们要注意两个问题,其一是生成1mol水时对应的能量,其二是释放出的能量,语言中已经包含的“-”号。 答案:B 例6 向某一饱和硫酸铜溶液中,加入含18O的带标记的无水硫酸铜粉末a g,则如果保持温度不变,其结果是( ) A.无水硫酸铜不再溶解,a g粉末不变 B.溶液中可找到带标记的SO42-,而且白色粗末变为蓝色晶体,其质量大于a g C.溶液中可找到带标记的SO42-,而且白色粗末变为蓝色晶体,其质量小于a g D.溶液中可找到带标记的SO42-,但白色粉末逐渐变为蓝色晶体,溶液的质量分数不变。 解析:本题中我们要注意两个隐蔽条件。其一,向饱和溶液中加入溶质,会形成一个溶解平衡,所以溶液中也能找到带标记的SO42-。其二,向饱和溶液中加入的是无水硫酸铜,宏观上不仅没有溶解,反而是带走溶液中的水,使得原溶液过饱和,继续析出CuSO4·5H2O,所以质量会大于a g。 答案:B、D 4. 掌握化学特殊性发掘隐蔽条件 在化学计算题中,我们也会遇到数学的讨论类型,但是化学在讨论时,要注意学科的特殊性,如:气态烃含碳原子个数不超过4个(当然大于0个),化学上没有的物质不用书写,不能于“0”完全的划等号。 例7 10.0 mL 某气态烃在 50.0 mL O2 中充分燃烧,得到液态水和 35.0 mL 的气体混合物(所有气体的体积都是在同温同压下测得的),则该气态烃可能是( )。 A.CH6 B.C2H6 C.C3H6 D.C5H6 解析:用体积差进行计算: CxHy(g)+(x+y/4)O2(g) 1 1+y/4 10.0 ml 10.0+50.0-35.0=25.0 ml y = 6 从计算可知,该烃分子只需满足含氢原子个数为6即可,但是,没有CH6这种物质,同时C5H6并非气态烃。 答案:BD 例8 某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- A.NaHA溶液中:c(Na+) = c(A2-)+c(HA-)+c(H2A) B.NaHA溶液中:c(Na+)>c(HA-)>c(OH-)>c(H+) C.Na2A溶液中:c(Na+) + c(H+) = c(HA-) + c(OH-) + 2c(A2-) D.Na2A溶液中:c(Na+)>c(HA-)> c(H+) > c(OH-) 解析:从题干可知,该酸的第一步电离是完全电离,而第二步是部分电离(存在平衡讨论)。对于NaHA溶液,A项可依据物料守恒可得,但是由于第一步不可逆, HA-并未水解生成H2A,即溶液中不存在该物质,化学上认为不应写出该物质;B项同样只有HA-的电离,溶液应显出酸性;对于Na2A溶液,C项用电荷守恒可得,而D项考虑A2-的水解而呈现碱性。 答案:C (责任编辑:admin) |
