|
例谈元素周期表的五大功能 黑龙江省大庆市第五十六中学 卢国锋 维尔纳长式周期表(即高中化学教材附录中所展示的元素周期表)从结构上看,组合之精巧、分区之明晰、包容之完备,至今尚无突破,完美体现了元素周期律美学价值。同时,元素周期表还有很强的实用价值,笔者利用高中化学中一些常见习题,梳理了元素周期表的五大功能。 一、元素周期表的定位功能 例1:原子序数为110的元素被发现后,它的符号被国际纯粹与应用化学联合会推荐为Ds(德语Darmstadt的缩写),以纪念该元素的发现地德国.下列关于Ds的说法,不正确的是( )。 A.Ds原子在周期表中位于第7周期第ⅦB族 B.Ds是过渡元素 C.Ds原子的核外有110个电子 D.Ds为金属元素 解析:周期定位的依据,118种元素排列成7个横行即7个周期,1~3周期分别含2、8、8种元素,因元素种类少称为短周期,4~7周期分别含18、18、32、32种元素,因元素种类较多称为长周期。首先根据元素种类,敲定每周期的起始元素原子序数,H原子序数1,1加第1周期元素种类2,为第2周期起始元素Li的原子序数3,同理得其他周期原子序数3+8=11、11+8=19、19+18=37、37+18=55、55+32=87,110大于87应在第7周期。 族定位依据,18列16个族,7个主族,由短周期和长周期元素共同构成的族,罗马数字与后缀A组成,0族元素也是由短周期和长周期元素组成,因稀有气体的化合价定位0,不属主族。7个副族仅有长周期元素构成的族,罗马数字与后缀B组成,8、9、10这3列也是由长周期元素构成,称第Ⅷ族,此族特殊是由3列构成,其它1列为一族。 在长式周期表中各族的排列顺序为:ⅠA→ⅡA→ⅢB→ⅣB→ⅤB→ⅥB→ⅦB→Ⅷ→ⅠB→ⅡB→ⅢA→ⅣA→ⅤA→ⅥA→ⅦA→0族,18列元素分别与以上各族对应,第ⅢB的第六周期镧系第七周期锕系各有15种元素,第3列就是第ⅢB元素种类最多共32种元素。用110减去第7周期的开端元素原子序数得23,从第2列开始数,第3列第7周期锕系有15种元素,23-1(ⅡA)-15(ⅢB )-1(ⅣB) -1(ⅤB) -1(ⅥB) -1(ⅦB)-3(Ⅷ)=0,110号元素应在第Ⅷ族。副族元素与第Ⅷ族构成过渡元素,过渡元素都为金属元素;答案选A。 二、元素周期表的查找功能 例2:元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm):
(1)用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)  (2)上述五种元素的最高价氧化物对应水化物中酸性最强的是 (填化学式); (3)B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式为 ; (4)用电子式表示A、D形成化合物的过程 ;C、E形成化合物为 (填化学式),含化学键类型为 。 解析:此题由性质推位置,再由位置查找性质。价态特征:主族元素的最高正化合价=主族序数=最外层电子数=8-︱最低负化合价︱(O、F无最高正化合价)。A元素在第ⅡA族,又是半径比铍大的短周期元素,A是Mg,同理确定B是Al、C是S、D是Cl、E是O。位置如图 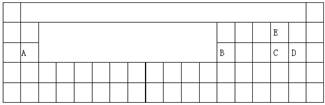 性质特征:同一周期从左到右金属性逐渐减弱,非金属性逐渐增强,同一主族从上到下金属性逐渐增强,非金属减弱。最活泼的非金属位于右上角(除稀有气体),元素的非金属性越强,其最高价氧化物的水化物的酸性越强,O无正化合价和含氧酸,非金属性强的是Cl元素,所以酸性最强的酸是HClO4;B的最高价氧化物对应水化物为氢氧化铝,C的最高价氧化物对应水化物为硫酸,它们反应的离子方程式为Al(OH)3+3H+═Al3++3H2O; 成键特征:活泼金属和活泼非金属元素之间易形成离子键,A和D元素形成的化合物是离子化合物氯化镁, 三、元素周期表的预测功能 例3:运用元素周期律分析下面的推断,其中错误的是( )。 ①113号元素的单质是一种金属,它的氧化物的水化物不能与强碱反应; ②砹(At2)是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体; ③铍的氧化物的水化物可能具有两性,硫酸铍(BeSO4)是难溶于水的白色固体; ④硒化氢(H2Se)是无色,有毒,比H2S稳定的气体; ⑤锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱; ⑥根据周期表中每个周期非金属元素的种类,预测周期表中应共有22种非金属元素(含0族元素)。 A.③④⑤⑥ B.④⑤⑥ C.②③④ D.③④⑥ 解析:未知元素的性质,在已知元素的性质相似的基础上,还要考虑递变性,除同族相似外还有对角线相似,如Li-Mg Be-Al B-Si。①113号元素位于第ⅢA族,金属性比Al强,它的氧化物的水化物,不具有两性不能与强碱反应;②砹(At2)属于卤素单质,性质与碘相似,非金属性比碘弱,所以At为有色固体,HAt不稳定;③铍与铝是对角线相似,其氢氧化物具有两性,溶解性与硫酸镁相似可溶;④硒化氢与H2S相似,非金属性比硫弱;⑤锂的金属性比钠弱空气中燃烧只能生成Li2O;⑥周期表除氢和氦以外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子(m)多于原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素。除第1周期外,每周期最后一种金属在与周期数相同的主族中,如第2周期元素最后一种金属在第ⅡA族,第2周期有2种金属,非金属有8-2=6种,同理推出3~7周期有非金属5、4、3、2、1,共23种。答案选A。 四、元素周期表的比较功能 例4:如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )。  A.离子半径:N>Z B.氢化物的稳定性;M<N C.失去电子能力:Y>Z D.单质的氧化性:N<X 解析:元素周期表的上下左右关系,用以比较元素的性质,元素性质包括核外电子的排布、主要化合价、原子半径、金属性、非金属性,及由此衍生的性质。依据同周期自左而右原子半径减小,同主族自上而下原子半径增大,前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为F元素,Y为Li元素,Z为Na元素,M为Si元素,N为Cl元素。N、Z两种元素的离子分别为Cl-、Na+,借助第三方元素如F-或K+,同主族元素原子和离子半径从上到下都是增大的,Cl->F-,Na+与F-具有相同电子层结构的离子,核电荷数越大离子半径越小Cl->F->Na+或Cl->K+>Na+;同周期自左而右非金属性增强,衍生具体性质有与氢气化合难易、气态氢化物的稳定性、最高氧化物水化物酸性强弱,非金属性Si<Cl,HCl比SiH4稳定;Li、Na同主族,自上而下金属性增强,失去电子能力增强;F、Cl同主族,自上而下非金属性减弱,单质氧化性减弱;答案选C。 五、元素周期表的指导功能 例5:19世纪中叶,门捷列夫总结出如表所示的元素化学性质变化情况。按照表中元素的位置,观察从ⅢA族的硼到ⅦA族的砹连接的一条折线,能从分界线附近找到 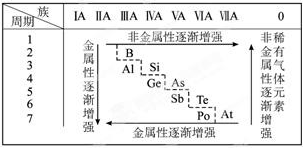 A.耐高温材料 B.新型农药材料 C.半导体材料 D.新型催化剂材料 解析:元素周期表对于其他与化学相关的科学技术有指导作用。耐高温的合金材料在过渡元素区寻找;制农药的元素在周期表右上方的非金属元素区寻找;做催化剂的元素从过渡元素区寻找;作半导体材料的元素,在元素周期表金属元素与非金属元素的分界线附近寻找,从ⅢA族的硼到ⅦA族的砹是元素周期表金属元素与非金属元素的分界线,作半导体材料的元素,答案选C。 (责任编辑:admin) |
