|
元素周期律(第一课时学案) 【学习目标】 1.了解元素周期表的简单分区。 2.认识周期表是元素周期律的具体表现形式。 【目标一】元素性质的周期性变化 1.元素化合价的周期性变化
2.元素金属性与非金属性的周期性变化 (1) Na、Mg、Al金属性强弱的比较 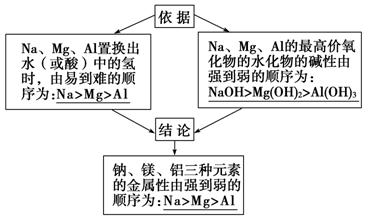 (2) 同周期元素性质的递变规律 随着原子序数的递增 【目标二】元素周期律 1.内容:元素的性质随着原子序数的递增而呈_____________变化。 2.实质:元素性质的周期性变化是_______________呈周期性变化的必然结果。 【思考感悟】 1.和酸反应时1mol Mg和1mol Al分别失去2mol e-和3mol e-,能否说明Al的金属性大于Mg? 2.H2SO3的酸性强于HClO,能否说明S的非金属性大于Cl? 【合作探究】 要点一:周期表中元素性质的变化规律
【强调】元素的性质与元素原子的核外电子排布的关系:元素原子的核外电子排布决定着元素的主要性质。 (1)一般来说,当最外层电子数少于4个时,易失去电子,表现出金属性;当最外层电子数多于4个时,易得到电子,表现出非金属性。 (2)当最外层为8个电子(氦为2个电子)时,原子处于稳定结构,化学性质稳定。 要点二:粒子半径(用r表示)“四同”比较 1.同周期 (1)规律:同周期,左→右,原子半径逐渐减小。 (2)举例:第三周期中:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。 2.同主族 (1)规律:同主族,上→下,原子(或离子)半径逐渐增大。 (2)举例:碱金属:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs);r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。 3.同元素 (1)规律:r(阴)>r(原)>r(阳),r(低价阳离子)>r(高价阳离子)。 (2)举例:r(Cl-)>r(Cl),r(Na)>r(Na+),r(Fe)>r(Fe2+)>r(Fe3+)。 4.同结构 (1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。 (2)举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。 【强调】粒子半径大小比较是考试中的热点,通常题目中进行粒子大小比较时用以上“四同”比较即可,但有时用以上方法不能直接解决时,可借助参照物,例如:比较r(K+)与r(Mg2+)可选r(Na+)为参照物,可知:r(K+)>r(Na+)>r(Mg2+)。 【导练】 1.(2011年大连高一检测)下列叙述正确的是( )。 A.电子的能量越低,运动区域离原子核越远 B.核外电子的分层排布即是核外电子的分层运动 C.稀有气体元素原子的最外层都排有8个电子 D.当M层是最外层时,最多可排布18个电子 2.(2011年高考天津卷改编题)以下有关原子结构及元素周期律的叙述正确的是( )。 A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子 B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 D.同主族元素从上到下,金属性逐渐减弱 3.(2011年天津高一检测)已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )。 A.原子半径:r(A)>r(B)>r(D)>r(C) B.原子序数:d>c>b>a C.离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) D.单质的还原性:A>B>D>C (责任编辑:admin) |
||||||||||||||||||||||||||||||||||||||||||
