|
元素周期表(第二课时 习题) 1.钾和钠的性质相似,下列说法中能较好地解释这个事实的是( )。 A.最外层电子数相同 B.都是金属元素 C.原子半径相差不大 D.最高化合价相同 2.下列关于碱金属的原子结构和性质的叙述中不正确的是( )。 A.最外层都只有一个电子,在化学反应中容易失去 B.都是强还原剂 C.都能在O2里燃烧生成过氧化物 D.都能与水反应生成碱 3.下列关于锂的性质的推测不正确的是( )。 A.它是一种活泼金属 B.投入冷水中能浮在水面上 C.投入到冷水中立即燃烧 D.它的氢氧化物是可溶性碱 4.下列说法正确的是( )。 A.碱性:LiOH>NaOH>KOH>RbOH B.金属性:Rb>K>Na>Li C.和酸反应时Fe能失2e-,Na失1e-,所以Fe的金属性强于Na D.Rb不易与水反应放出H2 5.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素( )。 A.一定是第2周期元素 B.一定是同一主族元素 C.可能是第2、3周期元素 D.可能相互化合形成化合物 6.X、Y、Z三种元素的原子序数都小于或等于20。它们的原子序数之和为42,且X、Y同主族,Y、Z同周期,则X、Y、Z依次可能是( )。 A.F、Cl、S B.Na、K、Mg C.O、S、Ar D.Ne、Mg、Ca 7.钾和另一种碱金属组成的18g合金与水完全反应,放出2.24L(标准状况)H2。合金中另一种金属可能是( )。 A.C B.Rb C.Na D.Li 8.碱金属单质的活动性Li<Na<K<Rb<Cs的根本原因是( )。 A.它们的熔点、沸点依次减小 B.原子最外层都有一个电子 C.它们的原子半径越来越大 D.它们与H2O反应越来越剧烈 9.同周期第IIA族与第IIIA族原子序数之差不可能为( )。 A.1 B.11 C.25 D.31 10.元素X和Y位于相邻两个周期,X、Y原子核外电子数之和为19,Y原子核内质子数比X核内质子数多3个,下列叙述中不正确的是( )。 A.X与Y可形成Y2X2型化合物 B.X离子与Y离子电子层结构相同 C.在自然界中X与Y只能以化合态存在 D.X在地壳中含量大于Y 11.下列关于铯的叙述正确的是( )。 A.硫酸铯是一种可溶性离子化合物 B.碳酸氢铯加热能迅速分解,碳酸铯受热不分解 C.铯能在氧气中燃烧生成氧化铯 D.在自然界中有少量游离态的铯存在 12.下列关于碱金属某些性质的排列中,正确的是( )。 A.原子半径:Li<Na<K<Rb<Cs B.密度:Li<Na<K<Rb<Cs C.熔点、沸点:Li<Na<K<Rb<Cs D.还原性:Li>Na>K>Rb>Cs 13.LiH是一种氢气发生剂,用于军事或其他需氢气的场合。反应为:LiH+H2O=LiOH+H2↑ 在这个反应中( )。 A.水是氧化剂,LiH是还原剂 B.LiH是氧化剂,水是还原剂 C.LiH既是氧化剂又是还原剂 D.该反应是非氧化还原反应,不存在氧化剂和还原剂 14.当质量为ag的某碱金属单质X与足量的氯气反应时,生成氯化物质量为(a+35.5)g,若将等质量的碱金属单质X与氧气反应,生成化合物的质量可能为( )。 A.(a+8)g B.(a+16)g C.(a+24)g D.(a+64)g 15.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,则下列说法中正确的是( )。 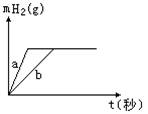 A.投入的Na、K一定等质量 B.投入的Na的质量小于K的质量 C.曲线a为Na,b为K D.稀盐酸的量一定是不足量的 16.X、Y、Z是周期表中短周期相邻的三种元素,X和Y同主族,Y和Z同周期,此三种元素最外层电子数之和为16,质子数之和为38,则X、Y、Z分别为_____。 17.W、X、Y、Z为短周期内除稀有气体元素外的四种元素,它们的原子序数依次增大,其中只有Y为金属元素,Y的最外层电子数和W相等;Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知: ⑴W为_____、X为_____、Y为_____、Z为_____。 ⑵它们之间可以组成的酸有__________。 ⑶它们之间可以组成的盐有__________。 18.有A、B、C、D四种短周期元素。A元素的离子焰色反应呈黄色。B元素正二价离子结构和Ne具有相同的电子层结构。5.8g B的氢氧化物恰好能与100mL 2mol/L的盐酸完全中和。H2在C单质中燃烧产生苍白色火焰。D原子的最外层电子数是次外层电子数的3倍。 ⑴元素C位于周期表第_____周期_____族,它的最高价氧化物的化学式为_____。 ⑵A与D形成的两种化合物的化学式为__________。 19.某同学为测定一定量的钠与水反应产生氢气的体积,设计了如图所示的装置(固定装置已省略)进行实验。图中的量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装有适量的水,甲管有刻度,供量气用;乙管可上下移动,以调节液面高低。 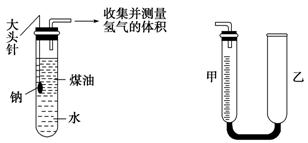 (1)实验开始,欲使钠与水接触反应,应进行的操作是___________________________。 (2)反应开始后,大试管中观察到的现象是_____________________________________。 (3)已知有关物质的密度ρ(K)=0.86g/cm3,ρ(Na)=0.97g/cm3,ρ(煤油)=0.80g/cm3。如果将钠换成相同大小的钾进行上述实验,结果钾反应所用的时间比钠反应所用的时间要______(填“长”或“短”),其原因是_____________________________。 (4)为了较准确地测量氢气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意________和________。(填字母编号) A.视线与凹液面最低处相平 B.等待片刻,待乙管中液面不再上升时,立刻读数 C.读数时应上下移动乙管,使甲、乙两管液面相平 D.读数时不一定要使甲、乙两管液面相平 (5)标准状况下,相同质量的钠、钾与足量的水反应产生氢气的体积之比为________。 (责任编辑:admin) |
