|
高一化学上学期期末备考,非金属及其化合物知识点总结。非金属化合物主要涉及硅元素、氯元素、一氧化碳、二氧化碳等,这些也是期末考试中的重点。高中化学家教老师整理出高中化学知识点总结高一化学非金属及其化合物知识点如下: 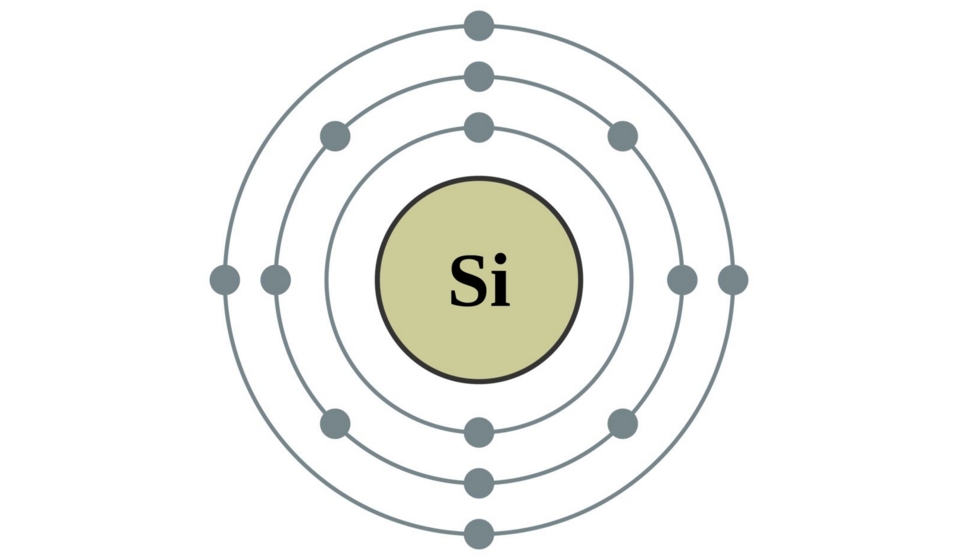 01硅元素 1.掌握Si和SiO2的理化性质:化学稳定性好、除 HF外一般不与其他酸反应,都可以与强碱(NaOH)反应,所以不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。 2.用途:硅单质是半导体材料,主要应用有集成电路,半导体晶体管及芯片;二氧化硅不导电,可做光导纤维、玛瑙、石英坩埚。 3.硅酸(H2SiO3)不溶于水,应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得 注意不能由SiO2一步制得H2SiO3 02氯元素 1.氯气的实验室制法: 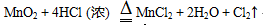 2.氯气的化学性质:很活泼,有毒,有氧化性, 能与大多数金属化合生成金属氯化物(盐)。也能与非金属反应,注意燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。 3.Cl2的用途: (1).自来水杀菌消毒:Cl2+H2O=HCl+HClO 1.体积的水溶解2体积的氯气形成的溶液为氯水,为浅黄绿色。其中次氯酸HClO有强氧化性和漂泊性,起主要的消毒漂白作用。次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效。 (2).制漂白液和漂白粉  (3).与有机物反应,是重要的化学工业物质。 (4).用于提纯Si、Ge、Ti等半导体和钛 (5).有机化工:合成塑料、橡胶、人造纤维、 农药、染料和药品 4.氯离子的检验  03二氧化硫 1.制备:硫黄或含硫的燃料燃烧得到(硫俗称 硫磺,是黄色粉末)S+O2=SO2 2.物理性质:无色、刺激性气味、容易液化, 易溶于水(1:40体积比) 3.化学性质:有毒,溶于水与水反应生成亚硫 酸H2SO3,形成的溶液酸性,有漂白作用, 遇热会变回原来颜色。这是因为H2SO3不稳定,会分解为水和SO2 04一氧化氮和二氧化氮 1.一氧化氮在自然界形成条件为高温或放电:  生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮:2NO+O2=2NO2 2.一氧化氮:无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。 3.二氧化氮:红棕色气体、刺激性气 味、有毒、易液化、易溶于水,并与水反应 05硫酸 1.物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大。 2.化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性。是强氧化剂。还能氧化排在氢后面的金属,但不放出氢气。 3.稀硫酸:与活泼金属反应放出H2 06硝酸 1.物理性质:无色液体,易挥发,沸点较低, 密度比水大。 2.化学性质:具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。还能氧化排在氢后面的金属,但不放出氢气。 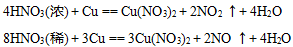 反应条件不同,硝酸被还原得到的产物不同,可以有以下产物:NO2,HNO2,NO,N2O,N2, NH3 3.硫酸和硝酸:浓硫酸和浓硝酸都能钝化某些金属(如铁和铝)使表面生成一层致密的氧化保护膜,隔绝内层金属与酸,阻止反应进一步发生。因此,铁铝容器可以盛装冷的浓硫酸和浓硝酸。硝酸和硫酸都是重要的化工原料和实验室必备的重要试剂。可用于制化肥、农药、炸药、染料、盐类等。硫酸还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸。 07氨气及铵盐 1.理化性质:无色气体,刺激性气味、密度小于空气、极易溶于水(1:700体积比)。溶于水发生以下反应使水溶液呈碱性: 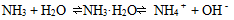 可作红色喷泉实验。 2.浓氨水易挥发除氨气,有刺激难闻的气味。氨气能跟酸反应生成铵盐: NH3+HCl = NH4Cl 3.用途:氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都离不开它。氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用作制冷剂。 4.铵盐的性质:易溶于水(很多化肥都是铵盐),受热易分解,放出氨气: NH4Cl= NH3↑+HCl↑ NH4HCO3=NH3↑+H2O↑+CO2↑ 可以用于实验室制取氨气:(干燥铵盐与和碱固体混合加热) NH4NO3+NaOH = NaNO3+H2O+NH3↑ 2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑ 用向下排空气法收集,红色石蕊试纸检验是否收集满。 相关您感兴趣的内容推荐: 高一化学上学期期末备考,考试规范要求及答题技巧 高一化学上学期期末备考,离子共存知识点总结 高一化学上学期期末备考,金属及其化合物知识点总结 高一化学上学期期末备考,混合物分离提纯知识点 高一化学上学期期末备考,非金属及其化合物知识点总结 (责任编辑:admin) |
