拓展解题思路 培养创造思维
|
|
解决化学习题时应注重试题解法的深挖掘和延伸,学会从不同角度思考和分析问题,这样既可以锻炼思维的敏捷性、创造性,活跃解题思路,又可挖掘学生的潜能。本文试以一道化学试题的解题方法加以阐述,并进行深化、拓展。希望本文能够给读者以启发,并能起到抛砖引玉的作用。
试题:在400 mL 0.5 mol/L的NaOH溶液中通入一定量的H2S气体,然后在溶液得到7.92 g 固体。试分析固体的组成并求出相应的物质的量。
 分析: 2NaOH+H2S(少)=Na2S+H2O ⑴
NaOH+H2S(足)=NaHS+H2O ⑵
由于题中未告知通入H2S的量,因此要分别以⑴⑵两种情况讨论:
已知:nNaOH=0.4×0.5=0.2 mol
若0.2 mol NaOH未参与反应,则剩余固体为NaOH 8 g;
若0.2 mol NaOH全部参与反应⑴,则剩余固体为Na2S 7.8 g;
若0.2 mol NaOH全部参与反应⑵,则剩余固体为11.2 g;
做图分析:
分析: 2NaOH+H2S(少)=Na2S+H2O ⑴
NaOH+H2S(足)=NaHS+H2O ⑵
由于题中未告知通入H2S的量,因此要分别以⑴⑵两种情况讨论:
已知:nNaOH=0.4×0.5=0.2 mol
若0.2 mol NaOH未参与反应,则剩余固体为NaOH 8 g;
若0.2 mol NaOH全部参与反应⑴,则剩余固体为Na2S 7.8 g;
若0.2 mol NaOH全部参与反应⑵,则剩余固体为11.2 g;
做图分析:
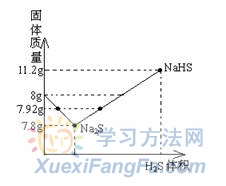 从图上可以看出,当固体质量7.8 g<m<8 g时,曲线在图上分布为两段,一段是NaOH和Na2S的混合物,一段是Na2S和NaHS的混合物;当固体质量8 g<m<11.2 g时,曲线表示为Na2S和NaHS的混合物。
解法:
依题意得,现在固体质量为7.92 g 固体,介于7.8 g和8 g之间,所以是NaOH和Na2S混合物或Na2S和NaHS的混合物。
讨论:
⑴若为NaOH和Na2S的混合物:设NaOH x mol,Na2S y mol.
则 有 x +2y=0.2 (Na元素守恒)
40x+78y=7.92
∴ x=0.12 mol,y=0.04 mol
⑵若为Na2S和NaHS的混合物:设Na2S x mol,NaHS y mol.
则有 x +2y=0.2 (Na元素守恒)
78x+56y=7.92
∴ x=0.096 mol,y=0.008 mol
拓展一(纵向—题型变脸1):
在0.2 mol/L的NaOH溶液中通入一定量的H2S气体,低温下小心蒸干溶液得固体10.2 g,则固体组成是 (C )
A. Na2S B. NaHS C. Na2S和NaHS D. NaOH和Na2S
拓展二(纵向—题型变脸2):
含8.0 g NaOH 的溶液中通入一定量的H2S后,将得到的溶液小心蒸干,称得无水物为7.92 g,则该无水物中一定含有的物质是(A )
A. Na2S B. NaHS C. Na2S和NaHS D. NaOH和Na2S
拓展三(纵向—题型变脸3):
用1 L 0.8 mol/L的NaOH溶液吸收0.5 mol H2S气体, 所得溶液中的S2-和HS-的物质的量浓度之比最接近于 ( C )
A. 2 : 1 B. 1 : 3 C. 3 : 2 D. 2 : 3
拓展四(横向—题型变脸4):
试题:在0.2 mol的NaOH溶液中通入一定量的CO2气体,然后小心蒸干溶液分别得到9.2 g和11.84 g 固体。试分析固体的组成。
分析:
2NaOH+CO2(少)=Na2CO3+H2O
NaOH+CO2(足)=NaHCO3+H2O
若0.2 mol NaOH未参与反应,则剩余固体为NaOH 8 g;
若0.2 mol NaOH全部生成Na2CO3为10.6g;
若0.2 mol NaOH全部生成NaHCO3为16.8 g;
\
从图上可以看出,当固体质量7.8 g<m<8 g时,曲线在图上分布为两段,一段是NaOH和Na2S的混合物,一段是Na2S和NaHS的混合物;当固体质量8 g<m<11.2 g时,曲线表示为Na2S和NaHS的混合物。
解法:
依题意得,现在固体质量为7.92 g 固体,介于7.8 g和8 g之间,所以是NaOH和Na2S混合物或Na2S和NaHS的混合物。
讨论:
⑴若为NaOH和Na2S的混合物:设NaOH x mol,Na2S y mol.
则 有 x +2y=0.2 (Na元素守恒)
40x+78y=7.92
∴ x=0.12 mol,y=0.04 mol
⑵若为Na2S和NaHS的混合物:设Na2S x mol,NaHS y mol.
则有 x +2y=0.2 (Na元素守恒)
78x+56y=7.92
∴ x=0.096 mol,y=0.008 mol
拓展一(纵向—题型变脸1):
在0.2 mol/L的NaOH溶液中通入一定量的H2S气体,低温下小心蒸干溶液得固体10.2 g,则固体组成是 (C )
A. Na2S B. NaHS C. Na2S和NaHS D. NaOH和Na2S
拓展二(纵向—题型变脸2):
含8.0 g NaOH 的溶液中通入一定量的H2S后,将得到的溶液小心蒸干,称得无水物为7.92 g,则该无水物中一定含有的物质是(A )
A. Na2S B. NaHS C. Na2S和NaHS D. NaOH和Na2S
拓展三(纵向—题型变脸3):
用1 L 0.8 mol/L的NaOH溶液吸收0.5 mol H2S气体, 所得溶液中的S2-和HS-的物质的量浓度之比最接近于 ( C )
A. 2 : 1 B. 1 : 3 C. 3 : 2 D. 2 : 3
拓展四(横向—题型变脸4):
试题:在0.2 mol的NaOH溶液中通入一定量的CO2气体,然后小心蒸干溶液分别得到9.2 g和11.84 g 固体。试分析固体的组成。
分析:
2NaOH+CO2(少)=Na2CO3+H2O
NaOH+CO2(足)=NaHCO3+H2O
若0.2 mol NaOH未参与反应,则剩余固体为NaOH 8 g;
若0.2 mol NaOH全部生成Na2CO3为10.6g;
若0.2 mol NaOH全部生成NaHCO3为16.8 g;
\ 做图分析:
从图中可以得出:
若固体m=9.2 g,因为8 <9.2<10.6 g,一定是NaOH和Na2CO3的混合物。
若固体m=11.84 g,因为10.6 <11.84< 16.8 g,一定是Na2CO3和NaHCO3的混合物。
拓展五(横向—题型变脸5):
试题:4.48 L(标况) H2S气体和一定量的O2 反应后,测得其体积变为1.12 L,试分析1.12 L的组成。
解法分析: 2H2S+O2=2S↓+2H2O ⑴
2H2S+3O2=2SO2+2H2O ⑵
若4.48 L H2S恰好发生反应⑴,则剩余气体体积为0 L
若4.48 L H2S恰好发生反应⑵,则剩余气体体积为4.48 L
现在有 0 <1.12 L<4.48 L
∴ 既发生了反应⑴又发生了反应⑵,即H2S和O2 完全发生了反应,并且O2只能使一部分S氧化成SO2。
做图分析:
做图分析:
从图中可以得出:
若固体m=9.2 g,因为8 <9.2<10.6 g,一定是NaOH和Na2CO3的混合物。
若固体m=11.84 g,因为10.6 <11.84< 16.8 g,一定是Na2CO3和NaHCO3的混合物。
拓展五(横向—题型变脸5):
试题:4.48 L(标况) H2S气体和一定量的O2 反应后,测得其体积变为1.12 L,试分析1.12 L的组成。
解法分析: 2H2S+O2=2S↓+2H2O ⑴
2H2S+3O2=2SO2+2H2O ⑵
若4.48 L H2S恰好发生反应⑴,则剩余气体体积为0 L
若4.48 L H2S恰好发生反应⑵,则剩余气体体积为4.48 L
现在有 0 <1.12 L<4.48 L
∴ 既发生了反应⑴又发生了反应⑵,即H2S和O2 完全发生了反应,并且O2只能使一部分S氧化成SO2。
做图分析:
 由图中可以看出,O2应该是不足量的,剩余的1.12 L气体可能为H2S气体,也可能为SO2气体。
综上所述,同一种类型的习题,加以深化、拓展,只要把握本质所在,就一定能够举一反三、触类旁通,达到事半功倍的效果。类似的反应还有NaOH和SO2反应、NaOH和H3PO4反应、P和Cl2的反应,这里就不再过多讲述。
由图中可以看出,O2应该是不足量的,剩余的1.12 L气体可能为H2S气体,也可能为SO2气体。
综上所述,同一种类型的习题,加以深化、拓展,只要把握本质所在,就一定能够举一反三、触类旁通,达到事半功倍的效果。类似的反应还有NaOH和SO2反应、NaOH和H3PO4反应、P和Cl2的反应,这里就不再过多讲述。
(责任编辑:admin)
织梦二维码生成器
------分隔线----------------------------