|
电镀过程是镀液中的金属离子在外电场的作用下,经电极反应还原成金属原子,并在阴极上进行金属沉积的过程。为了帮助大家学好高中化学电镀相关知识,高中学习网小编为您带来高中化学电镀反应及电镀的应用知识点总结,希望对大家有所帮助 高中化学电镀的知识点总结(一) 电镀: (1)概念:应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。 (2)目的:使金属增强抗腐蚀能力,增加美观和表面硬度。镀件(待镀金属制品)作阴极 (3)要求  如在铁制品表面上镀铜: 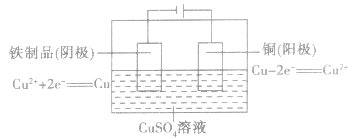 注意:理论上,电镀过程中电镀液的浓度保持不变。 相关高中化学知识点:电解精炼铜 精炼铜: (1)要求  (2)反应原理如下图所示: 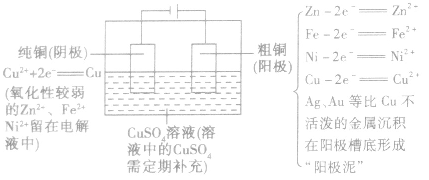 高中化学电镀的知识点总结(二) 1、电解饱和食盐水以制造烧碱、氯气和氢气 (1)电镀应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法 (2)电极、电解质溶液的选择: 阳极:镀层金属,失去电子,成为离子进入溶液,M—ne—== Mn+ 阴极:待镀金属(镀件):溶液中的金属离子得到电子,成为金属原子,附着在金属表面Mn++ ne—== M 电解质溶液:含有镀层金属离子的溶液做电镀液 镀铜反应原理: 阳极(纯铜):Cu-2e-=Cu2+ 阴极(镀件):Cu2++2e-=Cu 电解液:可溶性铜盐溶液,如CuSO4溶液 (3)电镀应用之一:铜的精炼 阳极:粗铜; 阴极:纯铜; 电解质溶液:硫酸铜 3、电冶金 (1)电冶金:使矿石中的金属阳离子获得电子,从它们的化合物中还原出来用于冶炼活泼金属,如钠、镁、钙、铝 (2)电解氯化钠: 通电前,氯化钠高温下熔融:NaCl == Na++ Cl— 通直流电后:阳极:2Na++ 2e—== 2Na 阴极:2Cl—— 2e—== Cl2↑ 规律总结:原(高中学习网Www.GaozhOng.cC/)电池、电解池、电镀池的判断规律 (1)若无外接电源,又具备组成原电池的三个条件。 ①有活泼性不同的两个电极; ②两极用导线互相连接成直接插入连通的电解质溶液里; ③较活泼金属与电解质溶液能发生氧化还原反应(有时是与水电离产生的H+作用),只要同时具备这三个条件即为原电池。 (2)若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池;当阴极为金属,阳极亦为金属且与电解质溶液中的金属离子属同种元素时,则为电镀池。 (3)若多个单池相互串联,又有外接电源时,则与电源相连接的装置为电解池成电镀池。若无外接电源时,先选较活泼金属电极为原电池的负极(电子输出极),有关装置为原电池,其余为电镀池或电解池。 以上是高中学习网小编为您带来的高中化学电镀的知识点总结,如果您还需要了解更多信息,请持续关注我们的网站 (责任编辑:admin) |
