|
考试时间150分钟,满分100分)
第Ⅰ卷(共55分) 一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意) 1.研究结果表明,在下列哪种情况下,许多实际气体很接近理想气体( )。 A. 高温、低压 B. 低温、高压 C. 高温、高压 D. 低温、低压 2.设NA为阿伏加徳罗常数,下列说法正确的是( )。 A. 标准状况下22.4 L SO3含有NA个SO3 B. 1 mol·L-1的NaOH溶液中,所含Na+总数为NA C. 1.9 g H3O+中含有1.1 NA个质子 D. 1 mol Cl2通入热的NaOH溶液中(主产物是NaCl、NaClO3),转移电子数为NA个 3.将0.54 g FeO完全溶解在50 mL 1 mol/L的H2SO4中,然后加入K2Cr2O7溶液25 mL,恰好使溶液中的Fe2+全部氧化为Fe3+, Cr2O72-离子全部还原为Cr3+,则K2Cr2O7的浓度为( )。 A. 0.05mol/L B. 0.1mol/L C. 0.2mol/L D. 0.3mol/L 4.在硫酸氢钠和硫酸钾的混合液中,当c(Na+)=0.2 mol/L、c(K+)=x mol/L、c(SO42-)=y mol/L时,x与y的关系是( )。 A.x=y-0.2 B. x=2y-0.2 C.x=2y-0.4 D. x=2y 5.关于碱金属盐的叙说错误的是( )。 A. 少数锂盐、铍盐属于共价化合物 B. 碱金属离子均无色,若有色都是阴离子引起的 C. 多数碱金属易形成复盐 D. 碱金属正盐的热稳定性都很好,难分解 二、选择题(本题包括15小题,每小题3分,共45分。每小题有1或2个选项符合题意) 6.标准状况下,将22.4 L NO2、NH3、O2混合气体通过足量稀硫酸后,溶液质量增加29.6 g,气体体积缩小为3.36 L,且剩余气体能使带火星的木条复燃,则原混合气体的平均相对分子质量为( )。 A. 30.2 B. 33.1 C. 34.4 D. 37.6 7.已知下列两个反应,前者比后者更易发生:(1)NH3+H+=NH4+ (2)2NH3+Ag+=[Ag(NH3)2]+(银氨络离子),欲从银氨溶液中转化出大量Ag+,适宜的试剂是( )。 A. HNO3 B. NaOH C. H2SO4 D. HCl 8.下列说法正确的是( )。 A. 所谓临界温度(Tc)就是在加压下使气体液化所需的最低温度 B. 临界温度越低,越难液化 C. 强极性分子具有较大的分子间作用力,故较易液化 D. 任何气体分子的液化,在降低温度或增加压力的条件下能实现 9.纳米是长度单位(1 nm=10-9 m),物质的颗粒到纳米级时,具有特殊性质。例如,将单质铜制成“纳 米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”与铜片的比较,正确的是( 0 A.“纳米铜”比铜片的金属性强 B.“纳米铜”比铜片更易失电子 C.“纳米铜”与铜片的还原性相同 D.“纳米铜”比铜片的氧化性强 10.经测定,某溶液中含有NO3-、HS-、SO32-、Cl-、CO32-和Na+,加入足量的Na2O2,待反应完全后,再加入过量的盐酸。最后溶液中存在上述六种离子中的( )。 A. 2种 B. 3种 C. 4种 D. 5种 11.下列反应的离子方程式书写正确的是( )。 A.过量的碳酸氢钠溶液与Ba(OH)2溶液反应: HCO B.氨水中通入过量二氧化硫:2NH3·H2O + SO2 ==== 2NH C.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+CO2+H2O D.将2 mol/L AlCl3溶液和7 mol/L NaOH溶液等体积混合: 2Al3++7OH- ===== Al(OH)3↓+ AlO 12.某无色溶液中,可能含Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种,取样后向其中滴加NaOH溶液,溶液中出现沉淀;另取样加入稀H2SO4也出现白色沉淀,并放出气体。据此分析,下列判断中正确的是( )。 ①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3 ④肯定有Na2CO3 ⑤肯定没有MgCl2 A. ①②③ B. ②④ C. ①③⑤ D. ①③ 13.将NH3和HCl气体分别置于一根120 cm的玻璃管两端,并使其自由扩散,则两气体在离NH3的什么位置相遇而出现白烟( )。 A.71.3 cm B. 81.3 cm C. 91.3 cm D. 101.3 cm 14.原子的核电荷数小于18的某元素X,原子的电子层数为n,最外层电子数为2n+1,原子中的质子数是2n2-1 。有关X的说法不正确的是(n为正整数)( )。 A.X能形成化学式为X(OH)3的碱 B.X肯定能形成化学式为NaXO3的含氧酸钠盐 C.X原子的最外层电子数和核电荷数肯定为奇数 D.X可能与元素Y形成Y3X2型化合物 15.为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:3NO2+2NaOH→NaNO3+NaNO2+H2O;NO2+NO+2NaOH→2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为( )。 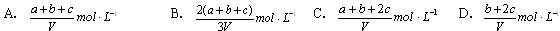 16.已知Fe3+的氧化性与Ag+不相上下。在含有Cu(NO3)2、Fe(NO3)3和AgNO3的溶液中加入少量铁粉,首先被置换的是( )。 A.Cu B. Ag C. Fe D. Fe和Ag 17.1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )。 A.Na2CO3 B.Na2O2 Na2CO3 C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3 18.1 L某混合溶液中,溶质X、Y浓度都为0.1 mol·L-l,向混合溶液中滴加某溶液Z(0.1 mol· L-l氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别( )。 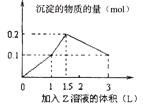 A.氯化铝、氯化铁、氢氧化钠 B.氯化铝、氯化镁、氢氧化钠 C.偏铝酸钠、氢氧化钡、硫酸 D.偏铝酸钠、氯化钡、硫酸 19.以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(mo1)分别为( )。 A.0.50、0.50、0.50 B.0.50、1.0、1.5 C.0.25、1.0、1.5 D.1.0、0.25、0.17 20.下列反应中,属于液氨的酸碱反应的是( )。 A.NaNH2+NH2Cl=NaCl+N2H4 B.CaO+2NH4Cl=CaCl2+2NH3+H2O C.BiN +3NH4Cl=BiCl3+4NH3 D.NH4Cl+ NaNH2=NaCl+2NH3
第Ⅱ卷(共45分) 三、本大题包括3小题,共19分 21.(6分)填写合适的物质: ⑴在Mg(HCO3)2溶液中加入过量澄清石灰水,最终生成的沉淀是 ⑵在含有浓度大致相当的Cl-、Br-、I-、S2-等离子的混合液中逐滴滴加AgNO3溶液,最先产生的沉淀是 ⑶HCl能使CH3COONa转化为CH3COOH,H2CO3能使C6H5ONa转化为C6H5OH,CH3COOH能使NaHCO3转化为H2CO3。由以上实验事实可知酸性由强到弱的顺序 22.(7分)根据摩尔质量M= ,理想气体在恒温下的 23.(6分)某实验测出人类呼吸中各种气体的分压/Pa如下表所示:
⑴ 请将各种气体的分子式填入上表。 ⑵ 指出表中第一种和第二种呼出气体的分压小于吸入气体分压的主要原因。 四、实验题(14分) 24.铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。 【方案一】 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是 〖实验步骤〗 (1)称取5.4 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”、“偏低”或“无影响”)。 【方案二】 〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 〖问题讨论〗 (1)同学们拟选用下列实验装置完成实验: 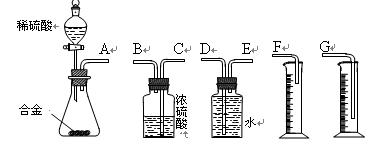 ①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。 A.待实验装置冷却后再读数 B.上下移动量筒F,使其中液面与广口瓶中液面相平 C.上下移动量筒G,使其中液面与广口瓶中液面相平 D.视线与凹液面的最低点水平,读取量筒中水的体积 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了下图所示的实验装置。 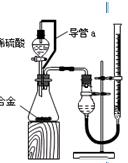 ①装置中导管a的作用是 。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为____________mL。 五、计算题(12分) 25.由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x。将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持1.01×105Pa,120℃收集所得气体,冷却、称量,真空管中固体质量增加y g。 (1)若a=1,则y=____________(用含x代数式表示)。 (2)若a=2,x=0.3时,y=_____________。 (3)若a=2,试讨论:x取值不同时,反应后所得气体成份及y的表达式(不一定填满)。
(4)若a=1.25,试作图表示y与x的关系。 参考答案与评分标准 一、共10分 ⒈A ⒉C ⒊A ⒋C⒌D 二、共45分
三、共26分 21.⑴Mg(OH)2 、CaCO3(2分) ⑵Ag2S(2分) ⑶CH3COOH>H2CO3>C6H5OH(2分) 22.(P/P)RT , 常数, P=0 , P/P , P→0 ,相对分子质量,极限密度法 23
呼出气中的N2的分压小于吸入气中的分压的主要原因是呼出气中的CO2和水蒸气有较大分压,总压不变,因而N2的摩尔分数下降(1分);呼出气中的O2的分压小于吸入气中的分压的主要原因是吸入的O2被人体消耗了。 (1分) 四、实验题(共14分) 25.【方案一】2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分) (1)97 mL (2分), (2)偏高(1分) 【方案一】(1)①EDG (2分) ②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大(1分) ③ACD(2分) (2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。(2分) ②V1-V2 (2分) 五、计算题(12分) 26.(1)y=26x+2(2分) (2)y=17.6(2分)
(3) (责任编辑:admin) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
