|
平衡常数在解题中的妙用 安徽合肥一中 张春 化学平衡是反应原理中非常重要的知识之一,而平衡常数则是解决这一类平衡问题的重要手段和方法,如果平衡常数运用得当,往往可以起到事半功倍的效果。现从以下几个方面来介绍平衡常数在解题中的妙用。 1. 判断反应进行的程度 K值越大,正反应进行的程度越大,反应物的转换率越高;K值越下,正反应进行的程度越下,逆反应进行的程度越大,反应物的转换率越低。 例1:(原创题)下列数据是一些反应的平衡常数,请判断:表示反应进行得最接近完全的常数是( ) A.K=3×103 B.K=2×10-10 C.K=3×105 D.K=2×1010 解析:K值越大,正反应进行的越完全。一般认为K>105时,即反应基本完成。故选D。 2. 判断反应的热效应 K值的大小与浓度、压强和是否使用催化剂无关,只与温度这一外界条件有关,温度发生变化时平衡常数也会发生改变。温度越高,K值越大,则正反应为吸热反应;温度越高,K值越小,则正反应为放热反应。 例2:(08年山东理综;有改动)高温下,某反应达到平衡,平衡常数 A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小 C.升高温度,逆反应速率减小 D.该反应的化学方程式为CO+H2O 解析:温度升高,K值变大,说明平衡向正反应移动,则正反应为吸热反应,故该反应的焓变为正值,A正确;恒温恒容下,增大压强,H2浓度应该增大或不变,故B错;升高温度,正逆反应速率都会增大,故C错;由平衡常数的表达式可得,该反应化学方程式应为CO2+H2 例3:
A. 3. 判断反应进行的方向 勒夏特列原理定义中减弱一词的含义较难理解,教学中使用平衡常数通过计算,定量进行比较,可以较好的突破平衡移动方向的判断难点。所以,平衡常数是将化学平衡移动原理定性的判定转化为定量的计算,从而使判断平衡移动更为准确。甚至用勒夏特列原理无法解释的问题,用平衡常数也可以快速的解决。 对于可逆反应:mA(g)+ nB(g) 例4:(原创题)在一定温度条件下,对于以达到平衡的反应: FeCl3 +3KSCN A.加入少量氯化钾固体 B.加入少量氯化铁固体 C.减少Fe(SCN)3的浓度 D.加水稀释 解析:该反应的本质是:Fe3+ +3SCN- 4 .计算转换率 利用温度不变时,平衡常数不变列方程求解。 例5:(08年宁夏理综)已知可逆 反应:M(g)+N(g) 请回答下列问题: (1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ; (2)若反应温度升高,M的转化率 (填“增大”“减小”或“不变”;) (3)若反应温度不变,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= ; (4)若反应温度不变,反应物的起始浓度为:c(M) = c(N)= b mol·L-1,达到平衡后,M的转化率为 。 解析:(1)M转化的物质的量为0.6 mol·L-1,则N反应的量也是0.6 mol·L-1,所以N的转化率为:×100%=25%。 ( 由于该反应的正反应为吸热反应,所以升高温度,化学平衡正向移动,M的转化率增大。 ( M(g)+N(g) 起始Ⅰ:1 2.4 0 0 平衡Ⅰ:0.4 1.8 0.6 0.6 起始Ⅱ:4 a 0 0 平衡Ⅱ:2 a-2 2 2 平衡Ⅰ和平衡Ⅱ温度相同,则K值相同, 故: 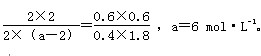 (4) M(g)+N(g) 起始: b b 0 0 改变: x x x x 平衡: (b-x) (b-x) x x 温度不变,K值相同,故:  点评:通过以上几个案例的分析,化学平衡常数在无机化学的解题中占有非常重要的位置;其用途之广,概括起来,无非是直接应用和综合应用两个方面。通过平衡常数可以直接判断一个反应进行的程度;也可以间接的通过平衡常数来判定反应的热效应和反应进行的方向;通过平衡常数也可以很好的解释浓度、压强和催化剂对平衡的影响;当然,平衡常数还可以应用于各种计算,求某些特定物质的转换率和浓度。 (责任编辑:admin) |