|
揭秘化学竞赛新热点——等电子原理 杭州市余杭高级中学 邹定兵 结构决定性质,性质反映结构;结构是物质性质的本源,性质是物质结构的具体表现。这是贯穿整个化学学习过程中,学生需要重点掌握的物质结构思想。作为《物质结构与性质》选修模块的拓展,等电子原理已成为各级化学竞赛试题的考查新热点。主要是因为这类试题所涵盖的知识具有极强的辐射性和发散性特点,能较好的考查学生对物质结构原理的活用,特别是对该原理的迁移和逻辑推理能力。为了便于学生掌握这一考点,笔者对等电子原理进行了分析、归纳,以供大家参考。 1、等电子原理 1919年,美国化学家Irving Langmuir在大量实验事实的基础上总结出一条经验规律,即等电子原理:原子数相同,电子数相同的分子,结构相似,物理性质相近。具有等电子特征的微粒互称为等电子体。常见的等电子体如N2和CO,其性质比较如表1。 表1 CO与N2的性质对比
2、等电子原理运用时需要注意的几个问题 2.1 明确等电子原理的含义 等电子原理中所讲的“电子数相等”既可以是指总电子数相等(如CO和N2,均为14),也可以是指价电子数相等(如N2和CN-,均为10)。因而互为等电子体的微粒可以是分子,也可以是离子。注意的是,若按价电子数相等计数时,此时价电子总数包括重原子(原子序数≥4)提供的价电子以及轻原子(H、He、Li)用来与重原子成键的电子,如N2和C2H2互为10电子体,其中,C2H2的总电子数就包括两个H原子与C原子形成C-H键的电子。此外,等电子原理中所指的“原子数相等”通常指的是重原子个数相等;“结构相似”也是针对重原子而言。因此,等电子原理也可以理解为:重原子数相等,总电子数相等的分子或离子,重原子的空间构型通常具有相似性。 2.2 明确等电子原理适用的范围 运用等电子原理预测分子或离子的空间构型时,不能简单的认为价电子数相等的两种微粒即为等电子体,必须注意等电子体用于成键的轨道具有相似性。例如CO2和SiO2,若单从价电子数相等角度考虑,二者看似互为等电子体,实则不然,两者的空间结构相差甚远。原因是,在CO2中,除了C原子以sp杂化轨道分别与2个O原子的p轨道以s键结合,还有2个离域的键;而SiO2中Si原子以sp3杂化轨道分别与4个O原子的p轨道以s键结合,同时,Si原子的d轨道还与O原子的P轨道形成了离域的p键。因此,成键轨道是否具有相似性是运用等电子原理判断分子或离子空间构型的前提。 3、常见的等电子体 中学常见的等电子体价电子数有8、10、14、16、18、24、26、30、32、48十种,按照重原子总数的不同可以归类如下(表2)。 表2 常见的等电子体及空间构型
4、等电子原理的考查 4.1考查等电子体的书写 例1. (2005 湖北化学竞赛初赛试题)H2O2是一种绿色氧化剂,应用十分广泛。1979年化学家将H2O2滴入到含SbF5的HF溶液中,获得了一种白色固体A。经分析,A的阴离子呈八面体结构,阳离子与羟胺NH2OH是等电子体。 (1)确定A的结构简式。写出生成A的化学方程式。 (2)若将H2O2投入到液氨中,可得到白色固体B。红外光谱显示,固态B存在阴阳两种离子,其中一种离子呈正四面体。试确定B的结构简式。 (3)上述实验事实说明H2O2的什么性质? 解析 本题第(1)、(2)问是对等电子原理的间接考查。A的阴离子呈八面体结构,结合题目所给信息,分析可知,A的阴离子应该是PF6-的等电子体SbF6-;A的阳离子与羟胺NH2OH是等电子体,同样结合题干信息分析可知,阳离子应该是H3O2+。综上所述,A的结构简式为[H3O2]+[SbF6]-。固态B存在阴阳两种离子,其中呈正四面体结构的必为NH4+,阴离子应该是H2O2的等电子体HO2-,因此B的结构简式为NH4 OOH。 答案(1) (2)NH4 OOH (3)上述实验事实说明H2O2既具有酸性,又具有碱性。 4.2 考查等电子体的结构 例2.(1998 全国化学竞赛试题)锇的名称源自拉丁文,原意“气味”,这是由于锇的粉末会被空气氧化为有恶臭气味的OsO4(代号A,熔点40℃,沸点130℃)。A溶于强碱转化为深红色的[OsO4(OH)2]2-离子(代号B)。向含B的水溶液中通入氨,生成C,溶液的颜色转化为淡黄色。C十分稳定,是A的等电子体,其中锇的氧化态仍为+8。红外谱图可以检出分子中某些化学键的振动吸收。红外谱图显示,C有一个四氧化锇所没有的振动吸收。C的含钾化合物是黄色的晶体,与高锰酸钾类质同晶。 (1)写出C的化学式。 (2)写出A、B、C最可能的立体结构。 解析:本题所给信息较多,但仔细分析之后不难发现,C物质是众多信息的核心,如C是[OsO4(OH)2]2+与NH3反应的产物;C是OsO4的等电子体;C的含钾化合物(KC)与KMnO4类质同晶等。因此,解答本题最明智的做法是以C为中心建构关系图,理清相互间的联系,从而确定C的组成。思考线索可图解如下: 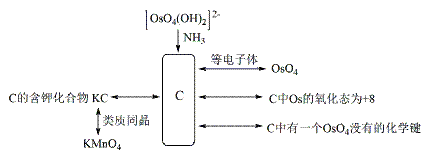 C是[OsO4(OH)2]2+与NH3反应的产物表明C中应该有N;C的含钾化合物KC是KMnO4的类质同晶可确认C是-1价离子;又知C是OsO4的等电子体且C中Os的氧化态仍等于+8,因此, 可确定C的化学式为OsO3N-;这个结构与C中有一个OsO4没有的化学键恰好吻合。 答案 (1)OsO3N- (2)  例3.(1991 安徽化学竞赛试题)1919年Langmuir提出:“凡原子数与电子总数相等的物质,则结构相同,物理性质相近”,称为等电子原理。相应的物质互称为等电子体。(BN)n是一种新的无机合成材料,它与某单质互为等电子体。工业上制造(BN)n的方法之一是用硼砂和尿素在1073~1273K时反应,得到a-(BN)n 及其他元素的氧化物,a-(BN)n 可作高温润滑剂、电器材料和耐热材料等。如在更高的温度下反应,可制得b-(BN)n, b-(BN)n硬度特别高,是作超高温耐热陶瓷材料、磨料、精密刀具的好材料。试问: (1)它与什么单质互为等电子体? (2)写出硼砂与尿素反应的方程式。 (3)根据等电子原理画出a-(BN)n 和b-(BN)n的结构。 解析 由于BN的价电子数=3+5=8,(BN)n的价电子数为8n(2×4n),运用等量异质替换(BN)n?(C2)n。再根据题中所给信息,与碳的同素异形体进行类比,可知与金刚石和石墨的价电子数(4n)相等(n→∞,4n与2×4n相等)。由此可推知:a-(BN)n 结构与石墨相似,而b-(BN)n 与金刚石相似。 答案(1)a-(BN)n、b-(BN)n与石墨、金刚石互为等电子体。 (2)nNa2B4O7 + 2nCO(NH2)2 === 4(BN)n + Na2O + 4nH2O +2nCO2 (3) 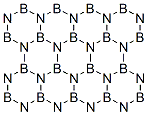 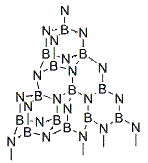 a-(BN)n b-(BN)n 4.3 考查等电子体的性质 例4.(2010 浙江化学竞赛试题)下图中,A、B、C、D、E、F在常温时均为气体,A、B分子中的电子数相同,G、H均为含氧化合物,其中反应生成的水及含铜化合物均略去,反应条件未注明。 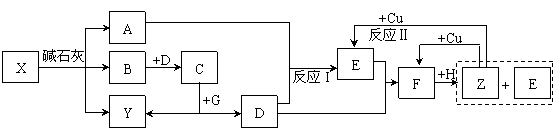  试根据上图各物质间的变化回答下列问题: (1)写出X的化学式 ; (2)写出物质C和Y的电子式:C 、Y ; (3)反应Ⅰ的化学方程式 ; (4)反应Ⅱ的离子方程式 ; (5)在上述各步反应中,有两种物质既做氧化剂又做还原剂,它们是 、 。 解析 这是一道典型的框图推断试题,解这类试题的关键是要找到“突破口”。本题的解答可从Z物质入手,根据Z与Cu反应产物的不同,可初步判断Z为HNO3,进而推测D为O2,E为NO, F为NO2,H为H2O。O2能够与A反应产生NO气体,则A可能为NH3或N2。又A与B具有相同电子数,可以大胆的猜测,如果A为N2,则B为其等电子体CO。显然,很难在中学化学范围内找到一种能够与碱石灰作用产生N2和CO混合气体的物质。因而,可以推测A为NH3,B为其等电子体CH4,余皆迎刃而解。 答案(1)CH3COONH4 (2)C的电子式为 (3)反应Ⅰ的化学方程式: (4)反应Ⅱ的离子方程式: (5)Na2O2、NO2 例5.(2008 全国化学竞赛备用试题) POCl3和NH3作用生成一种易溶于水的晶体C,它在NaOH溶液中水解浓缩得化合物D,D于483K时置于真空条件下发生缩合反应生成E,数天后将E在水中重结晶得到含十个结晶水的盐类F,F和十水焦磷酸钠是等电子体。 (1)写出POCl3和NH3作用生成C的反应方程式。 (2)写出C在NaOH溶液中水解生成D的反应方程式。 (3)写出D转变为E的反应方程式,画出E的阴离子结构简式。 解析 本题可采用逆推法解答,首先确定F的化学式,其余物质皆追根溯源可一一确定。由于F与十水焦磷酸钠是等电子体,结合题意可以确定F为 答案(1) (2) (3)  下载: (责任编辑:admin) |
