|
《化学反应速率和限度》同步测试(第1课时) 贵州省遵义市第二中学 周厚彬 一、选择题 1.已知反应A+3B===2C+D在一分钟内A的物质的量浓度由2mol/L降为1mol/L,C的平均反应速率为( ) A.v(A)=1mol/(L·s) B.v(B)=3 mol/(L·s) C.v(B)=4mol/(L·s) D.v(C)=2mol/(L·s) 考查目的:考查化学反应速率的计算公式和用不同物质表示的速率之比等于计量数之比。 答案:D 解析: v(A)=△c(A)/△t =(2-1)mol/L÷1min=1mol/(L·min) v(A):v(C)=1:2 ∴ v(C)= 2mol/(L·min)。 2.下列说法中正确的是( ) A.0.1mol·L-1盐酸和0.1mol·L-1硫酸与2mol·L-1 NaOH溶液反应速率相同 B.大理石块和大理石粉与0.1mol·L-1盐酸反应的速率相同 C.等量的Mg粉、Al粉和0.1mol·L-1盐酸反应速率相同 D.0.1mol·L-1盐酸和0.1mol·L-1硝酸与相同形状和大小的大理石反应的速率相同 考查目的:考查影响化学反应速率的因素。 答案:D 解析:A选项是酸碱中和,硫酸的H+浓度是盐酸的2倍,所以速率不同;B选项中大理石块与盐酸接触面小,反应慢;C选项中Mg比Al活泼,反应速率快。 3.反应4A(s)+3B(g)===2C(g)+D(g),经2min,B的浓度减少0.6mol·L-1。对此反应速率的表示,正确的是( ) A.用A表示的反应速率是0.4mol·(L·min)-1 B.分别用B、C、D表示反应的速率,其比是3:2:1 C.在2min末的反应速率,用B表示是0.3mol·(L·min)-1 D.在这2min内用B和C表示的反应速率的值都是逐渐减小的 考查目的:考查化学反应速率概念和相关知识。 答案:B 解析:v(B)==0.3mol·L-1·min-1,由于A是固体,无法用浓度变化量表示,所以A不对;2min末的反应速率为瞬时速率,而0.3mol·L-1·min-1为平均速率;B速率减小,C速率增加。 4.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( ) 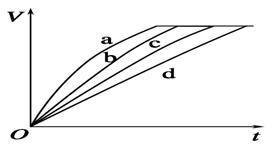
A.4、3、2、1 B.1、2、3、4 C.3、4、2、1 D.1、2、4、3 考查目的:考查浓度、温度、固体物质的表面积对化学反应速率的影响。 答案:AC 解析:其他条件一定时,溶液的浓度越大,化学反应速率越快;温度的升高和固体由块状变为粉末状都能显著加快反应速率。实验1中盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;实验3的反应温度比实验2的反应温度高,所以实验3的反应速率大于实验2的反应速率;实验3和实验4虽然浓度相同,但反应的温度不同,物质的状态也不相同,无法比较,故有A、C两种可能。 5.反应3Fe(s)+4H2O(g) A.增加Fe(s)的量 B.将容器的体积缩小一半 C.保持体积不变,充入N2使体系压强增大 D.保持压强不变,充入N2使容器体积增大 考查目的:考查增加固体、改变压强对化学反应速率的影响。 答案:AC 解析:固体、纯液体的浓度是一个定值,所以改变其物质的量对反应速率无影响。将容器体积缩小一半时,压强增大,反应速率加快。保持体积不变,充入N2,反应体系的浓度不变,反应速率不变。保持压强不变充入N2,容器体积增大,气体物质的浓度减小,反应速率减慢。 6.将4mol A气体和2mol B气体在2L容器中混合并在一定条件下发生如下反应:2A(g)+B(g)===2C(g),若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法,其中正确的是( ) ①用物质A表示的反应的平均速率为0.3mol·L-1·s-1 ②用物质B表示的反应的平均速率为0.6mol·L-1·s-1 ③2 s时物质A的转化率为70% ④2 s时物质B的浓度为0.7mol·L-1 A.①③ B.①④ C.②③ D.③④ 考查目的:考查化学反应速率、转化率、物质的量浓度的计算。 答案:B 解析:由题知2 s时C的浓度为0.6mol·L-1,根据化学方程式中化学计量数比可算出B的变化浓度为0.3mol·L-1,进而确定B的浓度是(1mol·L-1-0.3mol·L-1)=0.7mol·L-1;A的变化浓度为0.6mol·L-1,从而求出A的转化率=×100%=30%;用C表示的反应的平均速率为0.3mol·L-1·s-1,可推知用A表示的反应的平均速率为0.3mol·L-1·s-1,用B表示的反应的平均速率为0.15mol·L-1·s-1。对照各选项,符合题意的是B。 7.(体验高考)将5.6g铁粉投入足量的100mL 2mol/L稀硫酸中,2min时铁粉刚好完全溶解。下列有关这个反应的反应速率表示正确的是( ) A.铁的反应速率=0.5mol/(L·min) B.硫酸的反应速率=0.5mol/(L·min) C.硫酸亚铁的生成速率=0.25mol/(L·min) D.氢气的反应速率=0.5mol/(L·min) 考查目的:考查化学反应速率的计算和注意事项。 答案:B 解析:根据反应速率计算公式,需要计算2min时间内反应物浓度的变化量,在反应Fe+H2SO4===FeSO4+H2↑中,溶液中溶质浓度发生变化的只有反应物硫酸和生成物硫酸亚铁。5.6g Fe的物质的量==0.1mol。H2SO4的物质的量=生成FeSO4的物质的量=0.1mol。H2SO4的消耗速率=FeSO4的生成速率==0.5mol/(L·min)。 8.一定温度下,在固定体积的密闭容器中发生下列反应:2HI===H2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15 s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为( ) A.5 s B.10 s C.大于10 s D.小于10 s 考查目的:考查影响化学反应速率的因素和化学反应速率的计算。 答案:C 解析:随着反应不断进行:c(HI)逐渐减小,v(正)逐渐减小。所以,c(HI)由0.07mol·L-1降到0.05mol·L-1,所用时间应大于10 s。 9.其他条件不变时,能使反应速率加快的是( ) A.对于反应Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,增大体系的压强 B.对于N2(g)+3H2(g) C.对于N2(g)+3H2(g) D.对于N2(g)+3H2(g) 考查目的:考查压强对化学反应速率的影响。 答案:C 解析:此题着重考查压强对反应速率的影响。压强改变时,必须引起反应物浓度的变化,才能使反应速率发生变化,不能理解为“容器所受压强变化时反应速率就会发生变化”。 10.少量铁粉与100mL 0.01mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法的( ) ①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10mL 0.1mol·L-1盐酸 A.①⑥⑦ B.③⑤⑦ C.③⑥⑦ D.⑤⑥⑦ 考查目的:考查哪些条件能够影响化学反应的速率,意在考查学生分析推理的能力。 答案:C 解析:该反应的本质是:Fe+2H+===Fe2++H2↑,所以要加快反应速率同时不改变H2的产量可以采取升高温度、增大H+浓度、增大接触面积、使用催化剂等措施。加入浓HNO3虽然增大了H+浓度,但Fe与HNO3反应不会产生H2,会使H2的量减少;Na+和Cl-不参与反应,故加NaCl固体对反应速率无影响。 二、非选择题 11.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)===xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L·min)。求: (1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol。 (2)B的平均反应速率:v(B)=________mol/(L·min)。 (3)x的值为________。 考查目的:考查物质的量浓度、化学平均反应速率的计算等知识。 答案:(1)0.75 3 (2)0.05 (3)2 解析:(1)设原混合物中A、B的物质的量为a,列出起始时和5min时有关物质的量。 3A(g)+B(g)===xC(g) + 2D(g) 起始时(mol) a a 0 0 5min时(mol) a-1.5 a-0.5 0.1×2×5 0.5×2 根据c(A):c(B)=3:5,可得=,解得a=3 即n(A)=n(B)=3mol, 5min时c(A)==0.75mol/L。 (2)v(B)==0.05mol/(L·min)。 (3)由化学计量数之比等于物质的量的变化量之比,则=,解得x=2。 12.(体验高考)下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题: (1)实验4和5表明,________对反应速率有影响,______反应速率越快,能表明同一规律的实验还有__________(填实验序号)。 (2)仅表明反应物浓度对反应速率产生影响的实验有____(填实验序号)。 (3)本实验中影响反应速率的其他因素还有________,其实验序号是________。 (4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: ______________________。 考查目的:考查影响化学反应速率的因素,意在考查考生对比推理、图表分析和数据处理的能力。 答案:(1)固体反应物的表面积 表面积越大 1和2 (2)1、3、4、6、8(或2和5或7和9) (3)反应温度 6和7、8和9 (4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近 解析:(1)实验4和5的实验数据主要区别在于金属消失的时间上,粉末状金属的耗时明显少于丝状,说明固体反应物的表面积对反应速率有影响。(2)要研究反应物浓度对反应速率产生影响,就要排除金属状态的干扰,所以要选择状态一样的实验序号。(3)表中列出的影响反应速率的因素有金属状态、反应物浓度、溶液温度,实验7和实验9反应前温度与其他不同,接下来观察发现,实验7和实验6其他影响因素相同,实验9和实验8其他影响因素相同,这两对实验受反应温度的影响。(4)使溶液的温度升高的热量来于稀硫酸与金属的反应,反应前后溶液的温度变化值相近,说明各实验中反应的进行程度相近。 (责任编辑:admin) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
