|
《化学能与电能》同步测试(第2课时) 贵州省遵义市第二中学 周厚彬 一、选择题 1.下列装置中能组成原电池的是( ) 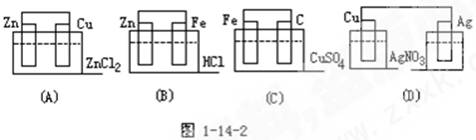 考查目的:考查原电池的形成条件。 答案:BC 解析:装置A中,锌和氯化锌溶液不发生反应,因此不能组成电源装置。另有误解锌能发生吸氧腐蚀,但由于吸氧腐蚀进行缓慢,而且产生电流很小,所以不将其视为电源装置。在装置D中,由于知识的欠缺,对原电池以及电解质溶液的导电原理认识不清,因此产生判断的错误。 2.下列说法中正确的是 ( ) A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 B.燃料电池是一种高效但是会污染环境的新型电池 C.化学电池的反应基础是氧化还原反应 D.铅蓄电池放电的时候正极材料是Pb,负极材料PbO2 考查目的:考查化学电池工作原理和分类,以及对环境的影响。 答案:C 解析:A项中碱性锌锰干电池是一次电池;燃料电池是一种高效、不会污染环境的新型电池,铅蓄电池放电的时候正极是PbO2,负极是Pb。因此选C项。 3.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( ) A.锌为正极,空气进入负极反应 B.负极反应为Zn-2e-===Zn2+ C.正极发生氧化反应 D.电解液肯定不是强酸 考查目的:考查锌电池的工作原理,考查学生对原电池原理的掌握情况。 答案:BD 解析:根据原电池反应的原理,负极发生氧化反应,较活泼的金属作负极,因此Zn-2e-===Zn2+是负极反应,正极发生还原反应。再根据电池总反应式,生成物是ZnO,ZnO能与强酸溶液反应,所以D项正确。 4.氢氧燃料电池以氢气为燃料,氧气为氧化剂,电极是多孔镍电极,电解质溶液为质量分数30%的KOH溶液,有关叙述正确的是 ( ) ①负极反应为2H2-4e-===4H+ ②负极反应为2H2+4OH--4e-===4H2O ③工作时正极pH增大,而负极pH减小 ④工作时负极pH增大,而正极pH减小 ⑤工作时溶液中阴离子移向正极 ⑥使用一段时间,KOH溶液质量分数仍为30% A.①②③ B.②③ C.②③⑥ D.④⑤ 考查目的:考查燃烧电池的工作原理,考查学生不同条件下电极反应式的书写,PH大小变化的判断。 答案:B 解析:氢氧燃料电池在碱性条件下,负极:2H2-4e-===4H+和4H++4OH-===4H2O(即2H2+4OH--4e-===4H2O),pH减小;正极:O2+4e-+2H2O===4OH-,pH增大。工作时溶液中OH-移向负极。使用一段时间,电解质的物质的量保持不变,由于生成了H2O,KOH浓度变小。 5.2010年上海世博会,上海将有千辆氢燃料电池车上路,关于氢燃料电池下列说法不正确的是( ) A.氢燃料电池是一种具有应用前景的绿色电源 B.氢燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 C.氢燃料电池能量转换率比氢气直接燃烧高 D.氢燃料电池工作时,发出淡蓝色火焰 考查目的:考查氢燃料电池的工作原理、应用和优点。 答案:D 解析:氢资源丰富,热值高,燃烧性能好,用于发电时,能量转换率高并实现零排放,若用可再生能源制氢,并形成循环,很有发展远景。使用时,可将氢气储存在储氢罐中。选项D错在,氢气没有燃烧,而是在负极上失电子,对于氢燃料电池电解质不同,负极发生的反应也不同,如强酸型介质时,负极发生H2-2e-===2H+;强碱性溶液中,负极发生:H2+2OH--2e-===2H2O。 6.将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,称为燃料电池,下列叙述正确的是( ) ①通入CH4的电极为正极; ②正极的电极反应是O2+2H2O+4e-=4OH-; ③通入CH4的电极反应式是CH4+2O2+4e-=CO2+2H2O; ④负极的电极反应式是CH4+10OH-=CO+7H2O+8e-; ⑤放电时溶液中的阳离子向负极移动; ⑥放电时溶液中的阴离子向负极移动。 A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③ 考查目的:考查燃料电池的工作原理和应用,考查学生对原电池原理的掌握情况。 答案:B 解析:一般说来,能自发进行的氧化还原反应,在理论上都可设计成原电池。据题意知发生的反应为CH4+2O2=CO2+2H2O,反应产生的CO2,处于KOH溶液中,又会转化为CO,故④是正确的。③O2得e被还原,作正极。④溶液中离子移动情况受溶液(原电池内电路)中电流方向影响,内电路电流方向是由负极流向正极,阳离子的移动方向与电流方向相同,故在溶液(原电池内电路)中阳离子向正极移动,阴离子向负极移动。 7.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe2++4OH-。以下说法正确的是( ) A.负极发生的反应为Fe-2e-===Fe2+ B.正极发生的反应为2H2O+O2+2e-===4OH- C.原电池是将电能转变为化学能的装置 D.钢柱在水下部分比在空气与水交界处更容易腐蚀 考查目的:考查钢铁在潮湿的空气中会形成原电池相关知识。 答案:A 解析:钢铁中含有C等杂质,在潮湿的空气中会形成原电池,Fe作负极而被腐蚀,负极反应:Fe-2e-===Fe2+,A正确。B中电荷不守恒,正确写法为2H2O+O2+4e-===4OH-。C说法适用电解过程,与原电池相反,原电池是将化学能转变为电能的装置。钢柱与水交界处更容易腐蚀,因为此处与氧气接触并具有潮湿的环境。 8.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( ) ①每消耗1mol CH4可以向外电路提供8mol e- ②负极上CH4失去电子,电极反应式CH4+10OH--8e-===CO+7H2O ③负极上是O2获得电子,电极反应式为O2+2H2O+4e-===4OH- ④电池放电后,溶液pH不断升高 A.①② B.①③ C.①④ D.③④ 考查目的:本题是考查原电池原理在燃料电池中的具体应用。 答案:A 解析:首先要判断出电池的正负极,其方法是确定在该电极上发生的是失电子反应还是得电子反应,若发生的是失电子反应,该电极是原电池的负极,反之是正极。CH4在铂电极上发生类似于CH4在O2中燃烧的反应,即CH4→CO2,严格地讲,生成的CO2还会与KOH反应生成K2CO3,化合价升高,失去电子,是电池的负极,电极反应式为CH4-8e-+10OH-===CO+7H2O,1mol CH4参加反应有8mol e-发生转移,O2在正极上发生反应,获得电子,电极反应式为O2+2H2O+4e-===4OH-。虽然正极产生OH-,负极消耗OH-,但从总反应CH4+2O2+2KOH===K2CO3+3H2O可看出会消耗KOH,所以电池放电时溶液的pH值不断下降,故①②正确,③④错误。 9.(体验高考)在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( ) A.正极附近的SO42 -离子浓度逐渐增大 B.电子通过导线由铜片流向锌片 C. 正极有O2逸出 D.铜片上有H2逸出 考查目的:考查原电池正负极现象的判断。 答案:D 解析:在该原电池中,电子流出的一极规定为电池的负极,所以锌片为负极;电子流入的一极为正极,所以铜片为正极。锌失去电子变成锌离子,在负极源源不断的产生阳离子(Zn2+),阳离子吸引阴离子向电源的负极移动,负极附近的SO42 -离子浓度逐渐增大。 10.(体验高考)天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 (A)充电时,电池的负极反应为LiC6-e- = Li++C6 (B)放电时,电池的正极反应为CoO2+Li++e- = LiCoO2 (C)羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 (D)锂离子电池的比能量(单位质量释放的能量)低 考查目的:考查原电池原理在锂离子电池中的具体应用,意在考查考生依据题干信息分析、提取信息的能力。 答案:B 解析:分析原电池反应:CoO2+LiC6 二、非选择题 11.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-===CO+3H2O。 (1)负极上的电极反应为______________________________。 (2)消耗标准状况下的5.6L O2时,有________mol电子发生转移。 (3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。 考查目的:考查燃烧电池在航天飞机中的应用,考查学生对原电池原理和电极反应式的掌握情况。 答案:(1)CH4+10OH--8e-===CO+7H2O;(2)1 ;(3)增大 解析:由总反应式知CH4失电子被氧化生成CO,一定有OH-参与反应,负极反应为CH4+10OH--8e-===CO+7H2O,正极反应为O2+2H2O+4e-===4OH-。根据正极反应式知1mol O2消耗时,转移4mol e-,n(O2)=0.25mol,故有1mol电子转移。放电时,正极产生OH-,故溶液的pH增大。 12.(体验高考) 依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。  请回答下列问题: (1)电极X的材料是________;电解质溶液Y是___________; (2)银电极为电池的________极,发生的电极反应为_______; X电极上发生的电极反应为____________________________; (3)外电路中的电子是从_______电极流向________电极。 考查目的:考查原电池的工作原理和电极反应式书写的掌握情况。 答案:(1)铜(或Cu);AgNO3溶液;(2)正, Ag++e- = Ag; Cu-2e- = Cu2+。 (3)负(Cu);正(Ag)。 解析:将氧化还原反应拆成两个半反应:一个是在负极发生的氧化反应,一个是在正极发生的还原反应;铜片失去电子被氧化,而失去电子即流出电子的一极为负极,所以铜片为负极,发生的反应为:Cu(s) -2e- = Cu2+(aq) ;电极X的材料是铜,电解质溶液是可溶性的银盐,可熔性的银盐只有硝酸银溶液;电子流入的一极为正极,银电极为电池的正极,发生的反应为:Ag++e- = Ag,外电路中的电子是从X(铜片、负极)电极流向Ag(正极)电极。 (责任编辑:admin) |
