|
《化学能与电能》同步测试(第1课时) 贵州省遵义市第二中学 周厚彬 一、选择题 1.某原电池的总反应离子方程式为:Zn+Cu2+===Zn2++Cu,则该原电池的正确组成可以是下列的( ) 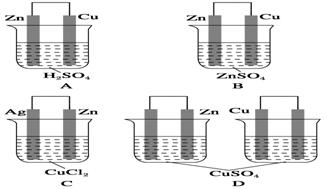 考查目的:考查原电池正负极材料和电解质溶液的选择。 答案:C 解析:该原电池负极为锌,正极是比锌稳定的金属/导电的非金属,电解质溶液中含有Cu2+。 2.如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( ) 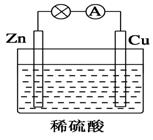  A.①②③ B.②④ C.②④⑥ D.③④⑤ 考查目的:考查原电池中正负极和电极反应的判断,电子的流向和计算,电极反应式的书写。 答案:B 解析:该电池中Zn作负极,Cu作正极。电极反应式为负极:Zn-2e-===Zn2+,发生氧化反应;正极:2H++2e-===H2↑,发生还原反应;放电时外电路中电子由负极流向正极,电解质溶液中阳离子移向正极,阴离子一般移向负极;由2H++2e-===H2↑知若有0.5 mol 电子流经导线,则可产生0.25 mol 气体。 3.如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( ) 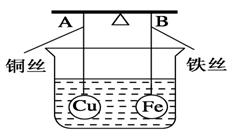 A.杠杆为导体和绝缘体时,均为A端高B端低 B.杠杆为导体和绝缘体时,均为A端低B端高 C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低 D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高 考查目的:考查原电池原理和形成的条件。 答案:D 解析:根据题意,若杠杆为绝缘体,滴入CuSO4溶液后,Cu在铁球表面析出,铁球质量增大,B端下沉;若杠杆为导体,滴入CuSO4溶液后,形成原电池,Cu在铜球表面析出,A端下沉。 4.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量CuSO4溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( ) 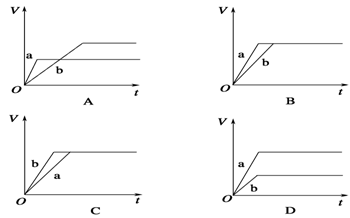 考查目的:考查原电池原理的应用。 答案:A 解析:a中由于加入少量CuSO4溶液,发生反应:Zn+CuSO4===ZnSO4+Cu,由于部分Zn用于置换Cu,因而产生的H2量减少,但同时形成Cu-Zn原电池,因而反应速率加快。 5.如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( ) 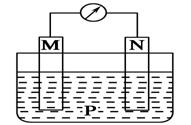
考查目的:考查原电池正负极的判断。 答案:C 解析:M棒变粗,N棒变细,说明N棒是负极,相对M棒金属活动性更强。M棒变粗说明M棒上有金属析出。 6.(体验高考)控制适合的条件,将反应2Fe3++2I-  A.反应开始时,乙中石墨电极上发生氧化反应 B.反应开始时,甲中石墨电极上Fe3+被还原 C.电流计读数为零时,反应达到化学平衡状态 D.电流计读数为零后,在甲中加入FeCl2固体,乙中的石墨电极为负极 考查目的:考查原电池相关知识的理解,同时也考查考生的读图能力。 答案:D 解析:由反应2Fe3++2I- 7.下列叙述正确的是( ) ①原电池是把化学能转化成电能的一种装置 ②原电池的正极发生氧化反应,负极发生还原反应 ③不能自发进行的氧化还原反应,通过原电池的装置可以实现 ④碳棒不能用来作原电池的正极 ⑤反应Cu+2Ag+===Cu2++2Ag可以进行 A.①③⑤ B.①④⑤ C.②③④ D.②⑤ 考查目的:考查原电池相关知识的理解和判断。 答案:A 解析:原电池中正极发生还原反应,负极发生氧化反应,碳棒可以作原电池的正极。 8.对于锌—铜—稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( ) ①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出1g H2 ④铜片上析出1 mol H2 A.①③ B.①④ C.②③ D.②④ 考查目的:考查原电池正负极现象的变化。 答案:A 解析:当导线中有1 mol电子通过时,溶解了0.5 mol锌,质量是32.5g;在铜片上析出0.5 mol氢气,质量是1g。 9.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 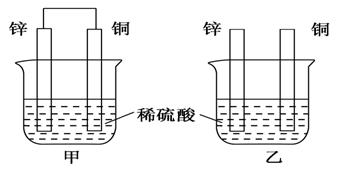 A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极 C.两烧杯中溶液的pH均增大 D.产生气泡的速率甲比乙慢 考查目的:考查原电池形成的条件及相关知识。 答案:C 解析:甲烧杯中铜片上有气泡冒出,乙烧杯中铜片上没有气泡产生;电化学反应速率比一般的化学反应速率快,甲装置是原电池装置,乙装置不是,所以化学反应速率甲比乙快。 10.(体验高考)在理论上不能用于设计原电池的化学反应的是( ) A.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O(l) ΔH<0 B.CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH<0 C.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3 ΔH<0 D.H2(g)+Cl2(g)===2HCl(g) ΔH<0 考查目的:考查能设计成原电池的化学反应满足的条件。 答案:A 解析:只有氧化还原反应才能设计成原电池,A项不是氧化还原反应,不能设计成原电池。 二、非选择题 11.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图: 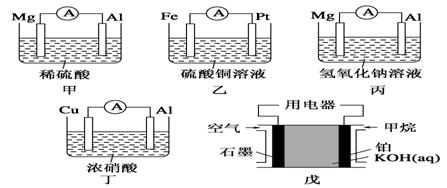 回答下列问题: (1)根据原电池原理填写下表:
(2)电极类型除与电极材料的性质有关外,还与________有关。 (3)根据上述电池分析,负极材料是否一定参加电极反应?________(填“是”“否”或“不一定”),请举例说明:_______________________________________________________。 (4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_________,丙________,戊________。(填酸性或碱性增强或减弱) 考查目的:考查原电池正负极的判断和材料的选择,电极反应式的书写、阴阳离子移动方向的判断及相关原电池知识,意在考查学生分析实验的能力。 答案:(1)
(2)电解质溶液的性质;(3)不一定 上述五个原电池中,戊装置的负极材料没有参与反应,其他电池的负极发生了氧化反应; (4)酸性减弱 碱性减弱 碱性减弱 解析:(1)电池甲:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应; 乙电池:铁比铂活泼,铁为负极; 丙电池:在氢氧化钠溶液中,铝与NaOH溶液反应,铝失去电子,发生氧化反应,铝离子与氢氧化钠反应生成偏铝酸根离子和水; 丁电池:常温下,浓硝酸使铝钝化,铜溶解,铜为负极; 戊电池是燃料电池,甲烷与氧气反应,甲烷发生氧化反应,在碱中生成碳酸盐和水,氧气发生还原反应。所以,在负极区通入甲烷,在正极区通入空气。 (2)通过比较甲、丙电池可知,电极都是铝、镁,由于电解质溶液不同,故电极名称不同,即电极类型与电极材料、电解质溶液都有关。 (3)大多数电池的负极材料参与反应发生氧化反应,燃料电池的负极材料不参与反应,可燃物如氢气、一氧化碳、甲烷、乙醇等在负极区发生氧化反应。 (4)根据溶液中离子参加反应情况判断溶液酸碱性的变化。 12.(体验高考)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。 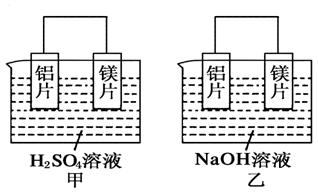 (1)写出甲中正极的电极反应式______________。 (2)乙中负极为________,总反应的离子方程式:_____________________________________。 (3)甲与乙同学均认为“如果构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。 (4)由此实验得出的下列结论中,正确的有________。 A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 B.镁的金属性不一定比铝的金属性强 C.该实验说明金属活动性顺序表已过时,没有实用价值了 D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析 考查目的:考查原电池原理的相关知识,意在考查考生对比、分析、推理的能力。 答案:(1)2H++2e-===H2↑ (2)Al 2Al+2OH-+2H2O===2AlO+3H2↑ (3)Mg Al (4)AD 解析:甲同学依据的化学反应原理是Mg+H2SO4===MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O===2NaAlO2+3H2↑。但是由于Al与碱的反应是一个特例,不可作为判断金属性强弱的依据,所以判断一个原电池的正、负极应依据实验事实。 (责任编辑:admin) |
