|
元素周期律(第二课时学案) 【学习目标】 1.了解元素周期表和元素周期律的应用。 2.体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。 【目标一】11号~18号元素的性质变化规律:
综上所述,我们可以从11~18号元素性质的变化中得出如下结论: Na Mg Al Si P S Cl Ar 【目标二】元素周期表和元素周期律的应用 1.根据元素在周期表中的位置推测其____________和性质。 2.根据元素的____________推测它在周期表中的位置。 3.指导新元素的发现及预测它们的原子结构和性质。 4.指导其他与化学相关的科学技术。 (1)如在周期表中________________的分界处,可以找到半导体材料。 (2)在____________中寻找催化剂和耐高温、耐腐蚀的合金材料。 (3)在元素周期表的右上角,寻找制取农药的元素。 【思考感悟】金属只有还原性,非金属只有氧化性对吗? 【导练】1.(2011年盐城高一检测)某元素的最高化合价为+m,它的最高价氧化物的水化物的分子中有b个氧原子,则这种最高价氧化物的水化物的化学式为( )。 A.Hm+2bXOb B.Hm-2bXOb C.Hb+mXOb D.H2b-mXOb 【合作探究】 要点一:元素的位置、结构、性质之间的关系及应用 1.元素的位、构、性之间的关系 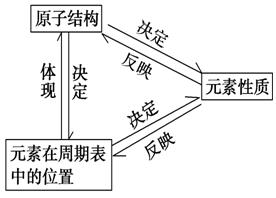 【特别提醒】元素的位、构、性之间的关系只适用于主族元素,不适用于副族元素。如Fe的最外层电子数为2,但其最高正价却是+3价。 2.解题过程中应注意的问题 (1)原子结构与元素周期表 ①核外电子层数=周期序数。 ②主族元素的最外层电子数=主族序数。 (2)化合价与元素周期表 ①主族元素:最高正化合价=___________=______________(价电子数)。 ②非金属元素:最高正价=原子所能失去或偏移的________________。 最低负价=使它达到___________稳定结构所需得到的电子数 ?最高正价+|最低负价|=____________。 要点二:预测新元素的结构及性质 1.“位、构、性”三者关系的解读 (1)原子结构元素在周期表中的位置 结构 位置 (2)原子结构元素的化学性质 结构性质 (3)位置体现或推测原子结构和元素性质 同一周期(左→右)→最外层电子数递增→非金属性增强,金属性减弱 同一主族(上→下)→电子层数递增→金属性增强,非金属性减弱 2.熟练掌握周期表中的一些规律 (1)各周期元素种类数 一~六周期元素种类分别为2、8、8、18、18、32,第七周期填满也是32种。 (2)稀有气体元素原子序数 一~六周期分别为2、10、18、36、54、86。 (3)同族上、下相邻元素的原子序数相差2、8、18、32。 (4)同周期ⅡA族与ⅢA族元素的原子序数相差1、1、11、11、25。 【导练】 2.(2011年岳阳高一检测)科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第七周期ⅣA族,称为类铅。关于它的性质,预测错误的是( )。 A.它的最外层电子数为4 B.它的最高价氧化物的水化物是强酸 C.它具有+2、+4价 D.它的金属性比铅强 (责任编辑:admin) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
