|
元素周期表(第二课时 学案) 【学习目标】 1.了解碱金属元素的原子结构及特点。 2.了解碱金属元素化学性质的相似性和递变性。 3.掌握元素金属性强弱的判断依据并能应用。 【目标一】原子结构 (1)相同点:碱金属元素原子的最外层电子数相同,都有____个电子。 (2)不同点:核电荷数不同、电子层数不同、原子半径不同。 (3)变化规律:随着核电荷数的增加,碱金属元素原子的电子层数逐渐______,原子半径逐渐______,原子核对最外层电子的吸引力逐渐______。失电子的能力越来越强。所以,从锂到铯金属性逐渐 【目标二】化学性质 (1)由于结构相似,所以它们的化学性质相似,例如都能与氧气以及水反应。 4Li+O2 2Na+2H2O=_____________; 2K+2H2O=2KOH+H2↑ (2)由于结构不同,所以化学性质有差异。例如金属锂与氧气反应只生成普通的氧化物,金属钠与氧气反应生成普通的氧化物和过氧化物。 (3)结构有变化规律,所以化学性质也有变化规律。例如钠和钾与水反应的剧烈程度:钾强于钠,碱金属单质从锂到铯________逐渐增强。 【目标三】物理性质 碱金属在物理性质上也表现出一些相似性和规律性。除铯外,其余碱金属都是________,硬度都比较____,有延展性,密度都比较小,熔点也比较_____,导热、导电性很好。并且碱金属元素从上至下,单质的熔、沸点逐渐 _________,密度呈现逐渐________的趋势。 【合作探究】 【要点一】 1.碱金属元素的原子结构 (1)相同点:最外层都只有1个电子,在反应中易失去一个电子,表现出还原性。 (2)不同点:核电荷数不同,电子层数不同,原子半径不同。 (3)递变规律:随着核电荷数的增多,它们的电子层数逐渐增多,原子半径逐渐增大。原子核对最外层电子的束缚能力越来越弱,失电子的能力越来越强。 2.碱金属单质的化学性质的相似性及递变性 (1)相似性(用R表示碱金属元素) 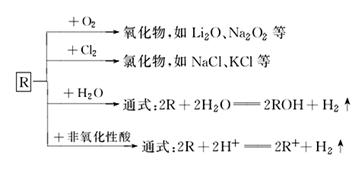 (2)递变性 ①与O2反应 从Li→Cs,与O2反应越来越剧烈,产物越来越复杂。如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。 ②与H2O(或酸)的反应 从Li→Cs,与H2O(或酸)反应越来越剧烈。如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。 ③最高价氧化物对应水化物的碱性 碱性:LiOH<NaOH<KOH<RbOH<CsOH。 【强调】Na、K与盐溶液的反应:因Na、K等很活泼的金属易与H2O反应,故当Na、K投入到盐溶液中时,不是从溶液中置换出相对不活泼的金属,而是先与水发生反应生成碱与氢气,然后生成的碱再与盐发生复分解反应(若不符合复分解反应的条件,则只发生金属与水的反应)。 【要点二】元素金属性强弱的判断 比较元素金属性的强弱,其实质是看元素原子失去电子的能力,越易失电子,金属性越强。 1.从元素原子结构判断 (1)当最外层电子数相同时,电子层数越多,原子半径越大,越易失电子,金属性越强。 即:同一主族,自上至下,元素金属性逐渐增强。 (2)当电子层数相同时,核电荷数越多越难失电子,金属性越弱(以后学)。 即:同一周期,自左至右,元素金属性逐渐减弱。 2.从元素单质及其化合物的相关性质判断 (1)金属单质与水或酸反应越剧烈,元素金属性越强。 (2)最高价氧化物的水化物的碱性越强,元素金属性越强。 3.根据金属活动性顺序判断 一般来说排在前面的金属元素其金属性比排在后面的强。 4.根据离子的氧化性强弱判断 离子的氧化性越强,则对应金属元素的金属性越弱。 如:氧化性Cu2+>Fe2+,则金属性Cu<Fe。 【强调】 (1)以上各规律反之仍成立,如某金属元素金属性越强,则单质与水(或酸)反应就越剧烈,最高价氧化物的水化物碱性越强。 (2)金属性强弱的比较,是比较原子失去电子的难易,而不是失去电子的多少。如Na失去一个电子,而Mg失去两个电子,但Na的金属性比Mg强。 【导练】 1.下列各组比较不正确的是( )。 A.锂与水反应不如钠与水反应剧烈 B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属Na C.熔、沸点:Li>Na>K D.碱性:LiOH<NaOH<KOH 2.下列对碱金属元素性质的叙述中,正确的是(双选)( )。 A.都是银白色的柔软金属(除铯外),密度都比较小 B.单质在空气中燃烧生成的都是过氧化物 C.碱金属单质与水剧烈反应生成碱和氢气 D.单质的熔、沸点随着原子序数的增加而升高 3.下列叙述中肯定能说明金属A比金属B活泼性强的是( )。 A.A原子最外层电子数比B原子的最外层电子数多 B.A原子电子层数比B原子的电子层数多 C.1mol A从酸中置换生成的H2比1mol B从酸中置换生成的H2多 D.常温时,A能从酸中置换出氢,而B不能 (责任编辑:admin) |
