|
例谈人教版《必修二》中的高频考点(一) 物质结构 元素周期律 湖南省长沙市第21中学 特级教师 邵国光 原子结构和元素周期律的内容是高考的必考内容之一,题型多以选择题、填空题、推断题的形式出现,主要考点有: 1.原子结构与各微粒间的关系,同位素、核素的概念及性质。 2.元素在周期表中的位置及元素性质的相似性、递变性。 3.物质所含化学键类型的判断及化合物类型的判断。 4.依据元素在周期表的位置进行元素推断及性质推断。该考点内容与元素化合物知识紧密联系,规律性强,命题空间广阔,题型灵活多变,预计今后的高考将会稳中有变,仍为以元素化合物知识为载体,利用元素周期律进行定性分析及推断。 题型一:核素、同位素的概念 同位素、核素的考查往往以新发现的核素、新物质为载体,结合最新发生的重大国际、国内事件进行命题,同时会兼顾考查同素异形体、同分异构体或原子结构的知识,这类题目一般起点较高,但落点很低,属于基础类题目,解题的关键在于看清题意,区分概念。如 (1)核素可用X(A为质量数、Z为质子数)来表示,一种核素就是一种原子。 (2)质子数、中子数、质量数之间的关系:质量数(A)=质子数(Z)+中子数(N)。 (3)同位素是同一元素不同核素之间的相互称谓,不指具体原子,H是一种核素,但不能说H是同位素。 (4)大多数元素都有同位素,所以核素的种类比元素的种类多。 (5)明确同位素、同素异形体、同分异构体的区别:
[例1](2013·全国大纲卷)下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )。 A.体积相等时密度相等 B.原子数相等时具有的中子数相等 C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等 解析:本题考查基本概念和基本理论知识,意在考查考生对一些重要概念与理论的理解能力。由于12C18O和14N2的相对分子质量不等,故体积相等的两种气体的质量不等,因此密度不等,所以A项错误;1个12C18O分子中有16个中子,1个14N2分子中有14个中子,二者均为双原子分子,原子数相等,即分子数相等,但中子数不等,所以B项错误;12C18O和14N2均为14电子分子,同温同压下,体积相等则分子数相等,所具有的电子数相等,所以C项正确;每个12C18O和14N2分子内均有14个质子,由于二者的相对分子质量不等,故等质量的两种分子所具有的质子数不等,所以D项错误。答案:C。 题型二:元素周期表和元素周期律 元素周期表中存在同主族与同周期两种递变规律,对这些规律的应用构成了这部分内容的题型,主要包括: (1)元素位置、元素种类、元素原子或离子结构、性质的推断。 (2)元素原子、离子半径大小的比较。 (3)金属性、非金属性强弱的比较。 (4)气态氢化物稳定性的比较。 (5)元素最高价氧化物对应水化物酸性、碱性强弱的比较。 解题时一般先依据元素周期表的结构确定元素在周期表中的位置,然后再利用元素周期律进行判断。解题时应注意:元素周期表中元素的“二性”: (1)氧化性和还原性:①同周期从左到右,单质的氧化性逐渐增强,同主族从上至下单质的氧化性逐渐减弱。如:Si<P<S<Cl2;F2>Cl2>Br2>I2。②同主族相同价态金属阳离子的氧化性从上到下逐渐减弱,如:Li+>Na+>K+>Rb+>Cs+。③同周期从左到右金属还原性逐渐减弱;同主族从上至下金属还原性逐渐增强。如:Na>Mg>Al;Li<Na<K<Rb<Cs。④同主族相同价态非金属阴离子还原性从上至下逐渐增强。如:F-<Cl-<Br-<I-。⑤气态氢化物的还原性。同周期从左到右逐渐减弱,同主族从上至下逐渐增强。如:H2S>HCl,HF<HCl<HBr<HI。 (2)酸性和碱性:①同周期从左到右元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;同主族从上至下元素最高价氧化物对应水化物的碱性逐渐增强,酸性逐渐减弱。如碱性:NaOH>Mg(OH)2>Al(OH)3;酸性:HClO4>HBrO4>HIO4。②同种元素不同价态的含氧酸,一般是形成该酸的中心元素的价态越高,酸性越强。如:H2SO4>H2SO3。 [例2](2013·山东高考)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )。 A.X、Y、Z中最简单氢化物稳定性最弱的是Y B.Z元素氧化物对应水化物的酸性一定强于Y C.X元素形成的单核阴离子还原性大于Y D.Z元素单质在化学反应中只表现氧化性 解析:本题考查元素周期表和元素周期律,意在考查考生运用知识的能力。由题意可知,W是N元素,X是O元素,Y是S元素,Z是Cl元素。H2S的稳定性小于H2O的稳定性,也小于HCl的稳定性,A项正确;HClO的酸性弱于H2SO4的酸性,B项错误;S2-的还原性大于O2-的,C项错误;Cl2和H2O反应时,Cl2既是氧化剂,又是还原剂,D项错误。答案:A。 题型三:化学键类型的判断 以新型物质的分子结构为载体,考查化学键的知识,是目前高考命题的一种形式。内容主要体现在以下三点: (1)物质中化学键类型的判断。 (2)化合物类型的判断。 (3)电子式的书写及用电子式表示物质形成的过程。 (4)10电子、18电子等微粒的判断。 解题时应注意: (1)离子化合物中一定有离子键,可能还有共价键。简单离子组成的离子化合物中只有离子键,如MgO、NaCl等。复杂离子(原子团)组成的离子化合物中既有离子键又有共价键,如(NH4)2SO4、NH4NO3、Na2CO3等。 (2)共价化合物中只有共价键,一定没有离子键。这是因为共价化合物中只有原子间的共用电子对,没有带电荷的阴、阳离子,如HCl、CH4等。 (3)在非金属单质中(除稀有气体分子外)只有共价键,如Cl2、O2等。 (4)构成稀有气体的分子为单原子分子,单原子分子中不存在化学键。 (5)非金属元素的原子间也可以形成离子键,如NH4Cl中的NH与Cl-。 (6)若10电子的微粒间存在如下反应: 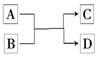 ,则该反应一定为:NH+OH-NH3↑+H2O。 ,则该反应一定为:NH+OH-NH3↑+H2O。[例3](2012·江苏高考)[双选题]短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )。 A.元素X的简单气态氢化物的热稳定性比W的强 B.元素W的最高价氧化物对应水化物的酸性比Z的弱 C.化合物YX、ZX2、WX3中化学键的类型相同 D.原子半径的大小顺序:rY>rZ>rW>rX 解析:根据X原子的最外层电子数是其内层电子总数的3倍可推出X为O;Y的最外层只有2个电子且原子序数比X的大,则Y为Mg;Z单质可制成半导体材料,则Z为Si,W与X同一主族且原子序数比X的大,则W为S。A项,非金属性越强,气态氢化物越稳定,正确;B项,硫酸的酸性比硅酸强,B错;C项,MgO中是离子键,SiO2中是共价键,SO3中是共价键,C错;D项,同周期从左到右原子半径减小,同主族从上到下原子半径增大,D正确。答案:AD。 题型四:元素在周期表中的位置及性质推断 依据元素的原子结构特点,元素在周期表中的位置及元素单质化合物的性质对元素进行推断。一般是给出原子半径的大小顺序、元素的主要化合价、元素原子的最外层电子数与内层电子数间的关系,元素在周期表中的位置等信息。题目往往限定为短周期元素或前20号元素,从而缩小了推断的范围。然后根据同一主族,同一周期元素性质的递变规律推断元素的性质。 解题时应注意: (1)推测元素及其单质或化合物所具有的性质首先要推断出该元素,然后根据元素周期律等进行下一步推断,其基本思路如下: 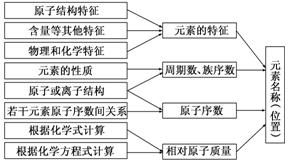 (2)元素推断一般考查的范围: ①第一周期:H。②第二周期:Li、C、N、O、F。③第三周期:Na、Mg、Al、Si、P、S、Cl。④第四周期:K、Ca、Fe。 [例4](2012·新课标全国卷)短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( )。 A.上述四种元素的原子半径大小为W<X<Y<Z B.W、X、Y、Z原子的核外最外层电子数的总和为20 C.W与Y可形成既含极性共价键又含非极性共价键的化合物 D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 解析:首先推断出W、X、Y、Z四种元素分别是H、C、N或O、Ne。选项A,C的原子半径大于O或N的原子半径,错误;选项B,四种元素原子的核外最外层电子数之和为1+4+5+8=18或1+4+6+8=19,错误;选项C,H与O可形成化合物H2O2,其中含有H—O极性键和O—O非极性键,H与N可形成化合物N2H4,其中含有N—H极性键和N—N非极性键,正确;选项D,C与H可组成很多固态烃类化合物,其沸点都高于H2O或NH3的沸点,错误。答案:C。 (责任编辑:admin) |
