|
《碱金属元素》测试题 重庆四十七中 陈 忆 一、选择题 1.下列关于碱金属元素叙述中正确的是( )。 A.原子的最外层电子数都是1,次外层电子层都是8 B.单质的化学性质活泼,易失电子发生氧化反应 C.除锂外均以化合态存在于自然界中 D.单质的密度都小于1 2.下列物质间反应时,可能引起爆炸的是( )。 A.钠和硫研磨B.氯化钠溶于水 C.过氧化钠中通入二氧化碳D.钾投入水中 3.下列关于铯的叙述正确的是( )。 A.硫酸铯是一种可溶性离子化合物 B.碳酸氢铯加热能迅速分解,碳酸铯受热不分解 C.铯能在氧气中燃烧生成氧化铯 D.在自然界中有少量游离态的铯存在 4.下列物品的盛放错误的是( )。 A.过氧化钾固体必须密封保存 B.烧碱必须密封保存 C.碱金属必须保持在煤油中 D.氢氧化钠溶液用带玻璃塞的玻璃瓶存放 5.在CuSO4溶液中加入下列物质①K ②Na ③Fe ④Ag,能置换出铜单质的是( )。 A.① B.①② C. ③④ D. ③ 6.下列关于碱金属某些性质的排列中,正确的是( )。 A.原子半径:Li<Na<K<Rb<Cs B.密度:Li<Na<K<Rb<Cs C.熔点、沸点:Li<Na<K<Rb<Cs D.还原性:Li>Na>K>Rb>Cs 7.用洁净的铂丝蘸取某无色溶液,进行焰色反应实验,直接观察时,火焰呈黄色,隔蓝色钴玻璃观察,火焰呈浅紫色,下列有关该无色溶液的叙述中正确的是( )。 A.一定是钾和钠的混合物 B.一定含K+,可能含Na+ C.一定含Na+,可能含K+ D.既含K+,又含Na+ 8.两种金属粉末的混合物13 g,溶于足量的稀H2SO4中,生成氢气1.0 g,则这种混合物不可能是( )。 A.Na和Mg B.Zn和Fe C.Mg和Al D.Al和Fe 9.在一密闭容器中盛有过量的NaHCO3和少量的Na2O2,将其加热到300 ℃经充分反应后,排出气体,容器内残留的固体是( )。 A.NaHCO3和NaOH B.Na2CO3和NaOH C.NaHCO3和Na2CO3D.只有Na2CO3 10.关于Li的结构和性质的判断,错误的是( )。 A.与水反应比钠剧烈 B.它的原子半径比钠小 C.它的氧化物暴露在空气中易吸收CO2 D.它的阳离子的最外层电子数和钠离子相同 11.有关Na2CO3和NaHCO3的叙述中正确的是( )。 A.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 B.Na2CO3比NaHCO3热稳定性强 C.Na2CO3和NaHCO3均可与澄清石灰水反应 D.Na2CO3和NaHCO3均可与NaOH溶液反应 12.将一定质量的金属钾放入236 g t ℃的水中,得到t ℃的氢氧化钾饱和溶液312 g,则t℃时KOH的溶解度是( )。 A.112 g B.56 g C.28 g D.76 13.现有2.8 g碱金属(R)及其氧化物(R2O)组成的混合物与足量水反应形成3.58g碱,则该金属为( )。 A.Na B.K C.Li D.Rb 14.某碱金属元素A的硫化物中,A和硫的质量比为7:16,硫的相对原子质量为32,则A的相对原子质量为( )。 A.7 B.14 C.23 D.39 15.铷和另一种金属的合金4.6g和足量的水完全反应时产生氢气0.2 g,则合金中另一金属一定是( )。 A.锂 B.钠 C.钾 D.铯 16.超氧化钾用于急救供氧 4KO2+2CO2 A.67.2 L B.22.4 L C.44.8 L D.11.2 L 17.m g过氧化钠和碳酸钠的固体混合物跟干燥的二氧化碳充分作用后,固体质量变为n g,则原混合物中过氧化钠的质量分数是( )。 A. C. 18.按下图装置持续通入x气体,并在管口点燃,实验结果使澄清的石灰水变浑浊,则x、y可以是( )。 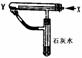 A.H2和NaHCO3 B.CO和Na2CO3 A.H2和NaHCO3 B.CO和Na2CO3C.CO和CuO D.H2和Fe2O3 19.某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量Na2O2固体,气体体积变小;最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是( )。 A.一定没有N2,CO和HCl中至少有一种 B.一定有N2、HCl和CO C.一定在N2、CO和HCl中至少有一种 D.一定有N2和HCl,一定没有CO 20.有甲、乙、丙三种溶液。甲溶液中加入Na2CO3溶液有白色沉淀生成,再加入乙溶液,沉淀溶解并有气体放出,再加入丙溶液,又有白色沉淀生成。由甲、乙、丙三种溶液依次是( )。 A.CaCl2、稀HNO3、BaCl2三种溶液 B.CaCl2、稀Na2SO4、K2SO4三种溶液 C.BaCl2、稀HNO3、Na2SO4三种溶液 D.CaCl2、稀HCl、Ba(NO3)2三种溶液 21.在氢氧化钠溶液中能大量共存的离子组成是( )。 A.K+、HCO3-、Cl-、SO42- B.S2-、CO32-、Cl-、K+ C.K+、Cu2+、SO42-、Na+ D.K+、Cs+、NO3-、SO42- 二、填空题 22.称取一定质量的纯碱,溶于水后与盐酸完全反应放出CO2,用“增大”或“减少”填空: (1)若纯碱中含NaHCO3,则所需盐酸用量,产生的气体。 (2)若纯碱中含K2CO3,则所需盐酸用量,产生的气体。 (3)若纯碱中含NaCl,则所需盐酸用量,产生的气体。 23.碱金属除略带金色光泽外,其余的都是,碱金属中密度最小的是,熔、沸点最低的是(除Fr) ,原子半径最大的(除Fr外,下同)是,金属性最强的是,钾的原子结构示意图是,式量最小的碱金属碳酸盐化学式是。 24.x、y、z、w是钾的化合物,且它们有以下关系: x w+H2O 则它们的化学式分别是: x y z w 三、推断题 25.有一包白色粉末,其中可能含有Na2CO3、NaCl、K2SO4、CuCl2、BaCl2、K2CO3和Na2SO4,现按下列步骤进行实验: (1)将该粉末溶于水得无色溶液和白色沉淀 (2)在滤出的沉淀中加入稀HNO3后,有部分沉淀溶解,同时产生无色气体 (3)取滤液做焰色反应,火焰呈黄色,隔着蓝色钴玻璃观察,未见紫色火焰。 由上述实验现象推断:混合物中一定含有,一定不含有,不能肯定是否含有。 四、实验题 26.要除去下列各溶液中的杂质,将所需试剂的化学式填在空白处,再写出有关的离子方程式
27.现有一定量含有Na2O杂质的Na2O2试样。请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3、约18%的盐酸和水) 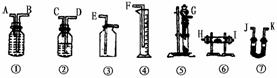 请填写下列空白: (1)写出在实验中Na2O2和Na2O分别发生反应的化学方程式 (2)应选用的装置是(只要求写图中装置的标号) (3)所选装置的连接顺序是(填各接口的字母,连接胶管省略) 五、计算题 28.质量为17.8 g的KOH和KHCO3混合物,在250 ℃加热,冷却后发现混合物质量损失4.0 g,求混合物中KOH、KHCO3质量分数各为多少? 29.现有Na2CO3和NaHCO3的混合物13.7 g,用过量的盐酸处理,共收集到气体6.6 g,求混合物中NaHCO3的质量分数。 30.今有0.99 g碱金属及其氧化物的混合物与水反应,生成的碱为1.38 g,求混合物的成分及质量。 (责任编辑:admin) |
