|
2018年高考二轮复习已经开始,相信你有了一轮复习基础知识的积累,在二轮复习能力提升上一定会得心应手。小编整理了2018高考化学二轮复习知识点专题,物质的分类知识专题总结如下: 要点一、简单分类法 1.分类法的涵义: 分类是根据对象的共同点和差异性,将对象区分为不同的种类,并且形成有一定从属关系的不同等级的系统的逻辑方法。它也是研究和学习化学物质及其变化的一种常用的科学方法。 2.分类的方法: 分类根据不同的标准,可以有不同的分类方法。交叉分类法和树状分类法是两种常用的、具体的分类方法。要点诠释:分类中要注意的问题 (1)确定分类的标准:当分类的标准确定后,同类事物在某些方面的相似性可以帮助我们举一反三;对不同类事物的了解使我们有可能做到由此及彼。 (2)认识事物时往往需要采用多种分类方法(如“交叉分类”法),以弥补单一分类法的不足,提供关于事物的更多方面的信息。例如,利用交叉分类法,Na2CO3既可以是钠盐,也可以是碳酸盐。又如,以下四种酸的交叉分类见下图:  (3)对同类事物进行再分类,即采用“树状分类”法。 树状分类法:确定更细的标准,对同一类物质进行再分类。这种分类法便于系统认识物质,强调了不同类别物质的内在联系,每一类物质之间没有交叉关系,培养了思维的系统性和严谨性。 要点二、化学物质的树状分类法  要点诠释: 【物质的分类】 1.氧化物: (1)氧化物的分类 从组成元素分:金属氧化物,如CuO、Al2O3; 非金属氧化物,如CO、CO2; 从性质上分:  (2)注意: ①.非金属氧化物不一定是酸性氧化物,如CO 、H2O属不成盐氧化物; ②. 金属氧化物不一定是碱性氧化物,如Mn2O7属酸性氧化物; ③. 酸性氧化物不一定是非金属氧化物,Mn2O7属金属氧化物; ④. 碱性氧化物一定是金属氧化物。 2.酸: 按酸是否含氧元素,可分为  H2SO4按照上面的分类可以是二元酸、强酸、稳定性酸、难挥发性酸。 3.碱: 按溶解性,可分为  要点三、分散系及其分类 1、分散系定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。前者属于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。 要点诠释: 按照分散质或分散剂的聚集状态(气、固、液)来分,分散系可以有以下9种组合:  2.溶液、胶体和浊液——三种分散系的比较 不同的分散系,其外观、组成等不同,其根本原因是分散质粒子大小不同。现将三种分散系的比较列于下表中。 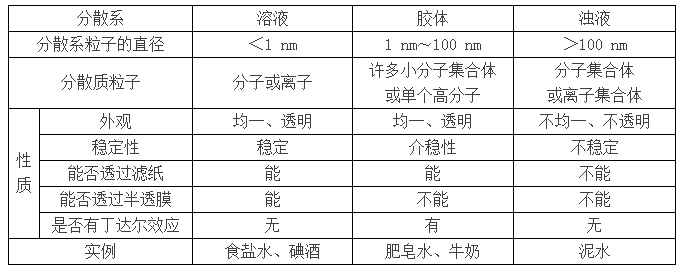 要点诠释: 当分散剂是水或其他液体时,按照分散质粒子的大小,可以把分散系分为溶液、胶体和浊液。溶液中分散质粒子小于1nm,溶液中的分散质我们也称为溶质;浊液中的分散质粒子通常大于100nm;胶体中的胶体粒子大小在1nm~100nm之间。因此,溶液和胶体的分散质都能通过滤纸,而悬浊液的分散质则不能通过滤纸。 这三类分散质中,溶液最稳定;浊液很不稳定,分散质在重力作用下会沉降下来;胶体在一定条件下能稳定存在,稳定性介于溶液和浊液之间,属于介稳体系。 要点四、胶体及其性质 1、定义:分散质粒子大小在1nm~100nm之间的分散系称为胶体。 我们把这些分散质粒子称为胶体粒子。胶体具有一些不同于溶液和浊液的特性: 2、Fe(OH)3胶体的制备和精制: (1)Fe(OH)3胶体的制备:向烧杯中煮沸的蒸馏水中逐滴加入5~6滴FeCl3饱和溶液,继续加热煮沸至溶液呈红褐色,就得到Fe(OH)3胶体。FeCl3+3H2O Fe(OH)3 (胶体)+3HCl使一束光线通过所得液体混合物,有丁达尔效应,证明形成了胶体。 (2)胶体的提纯与精制——渗析:利用半透膜将溶液和胶体分离的操作。渗析是利用溶质粒子能通过半透膜而胶体粒子不能通过半透膜进行溶液和胶体的分离。但渗析过程是可逆的,要达到分离目的应反复进行渗析或在流水中进行渗析。 3、胶体的性质:丁达尔效应 一束光通过胶体时会产生一条光亮的通路,这种现象叫丁达尔效应。丁达尔效应是区分溶液和胶体的物理方法。 要点五、各类物质间的相互关系一-无机反应规律 酸碱盐氧化物之间的相互关系如下图所示: 【物质的分类】 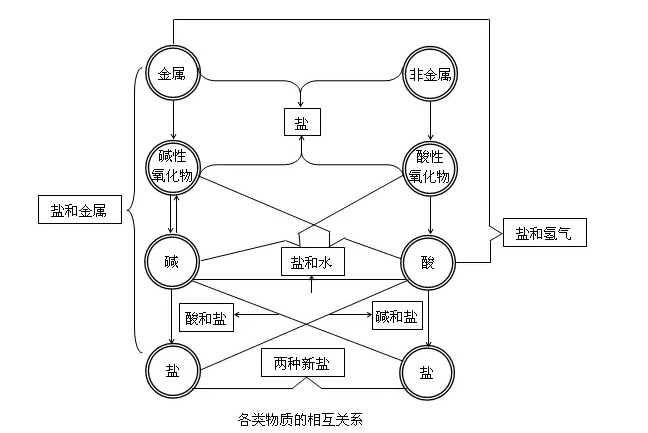 要点诠释: 既要掌握其所属类别的通性,还要掌握这种物质的特性。例如,酸与金属反应可以生成氢气和盐,这是一般规律,但并不是所有的酸和金属反应都产生H2;金属氧化物不都是碱性氧化物(如Mn2O7是酸性氧化物);碱性氧化物不都能与水反应生成相应的碱,如Fe2O3与H2O不反应。 (一)金属的性质: 1、与非金属的反应,可得无氧酸盐或金属氧化物。 2、与酸反应 (1)金属活动表H前面的金属与酸发生置换反应生成盐和H2 (2)金属与HNO3、浓H2SO4不发生置换反应 3、与盐溶液反应 (1)在金属活动顺序表中,排在前面的金属将后面的金属从盐溶液中置换出来。例如:Fe+CuSO4=Cu+FeSO4 (2)K、Na、Ca等非常活泼的金属与盐溶液不直接发生置换反应,其反应比较复杂。 (二)非金属的性质 1、与金属反应 2、与非金属反应 3、与氢气反应 4、与H2O的反应 C+H2O(气) CO+H2 (三)碱性氧化物的性质 1、与H2O反应: 碱性氧化物(易溶)+H2O→碱(易溶) 例如:K2O+H2O=2KOH CaO+H2O=Ca(OH)2 2、与酸性氧化物反应:碱性氧化物+酸性氧化物→含氧酸盐 例如:Na2O+SO3=Na2SO4 3、与酸反应:碱性氧化物+酸→含氧酸盐+水;例如CuO+2HNO3=Cu(NO3)2+H2O (四)酸性氧化物发生的反应 1、与水反应:酸性氧化物+水→酸 例如:SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4; 注意:SiO2难溶于水,不与水反应 2、与碱性氧化物反应:碱性氧化物+酸性氧化物→含氧酸盐 3、与碱反应:酸性氧化物+碱→盐+水;例如CO2+2NaOH=Na2CO3+H2O 注意:难溶性的碱与酸性氧化物不反应 (五)碱的性质 1、与酸性氧化物反应:碱+酸性氧化物→盐+水 2、与酸反应: 碱+酸+盐+水 3、与盐反应:强碱+弱碱盐→弱碱+强碱盐 即强碱制弱碱 例如:3NaOH+FeCl3=Fe(OH)3↓+3NaCl; KOH+NH4Cl=NH3·H2O+KCl,若反应物是浓溶液或加热时,则NH3·H2O分解生成NH3↑+H2O 4、难溶性碱的不稳定性:难溶性碱受热易分解, 难溶性碱性氧化物+水 例如:Cu(OH)2 CuO+H2O ; 2Fe(OH)3Fe2O3+3H2O 强碱稳定,受热难分解 (六)酸的性质 1、与金属反应(见前述) 2、与碱性氧化物反应:酸+碱性氧化物→含氧酸盐+水;例如CuO+2HNO3=Cu(NO3)2+H2O 3、与碱反应:碱+酸 盐+水 4、与盐反应: 强酸+弱酸盐→弱酸+强酸盐 ,即强酸制弱酸 例如:2HCl+Na2CO3=2NaCl+H2O+CO2↑ (七)盐的性质 1、与金属反应(见前述) 2、与碱反应(见前述) 3、与酸反应(见前述) 4、与盐反应: 盐+盐→生成两种新盐; 生成物要有沉淀 例如:CaCl2+Na2CO3=CaCO3↓+2NaCl; BaCl2+Na2SO4=BaSO4↓+2NaCl 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |
