|
2018年高考二轮复习已经开始,相信你有了一轮复习基础知识的积累,在二轮复习能力提升上一定会得心应手。小编整理了2018高考化学二轮复习知识点专题,氧化性强的非金属单质——氯气知识总结如下:  1.氯元素的原子结构 氯元素位于元素周期表中第三周期ⅦA族,最外层有7个电子,在化学反应中易获得1个电子而表现为-1价。自然界中氯主要以化合态形式存在。   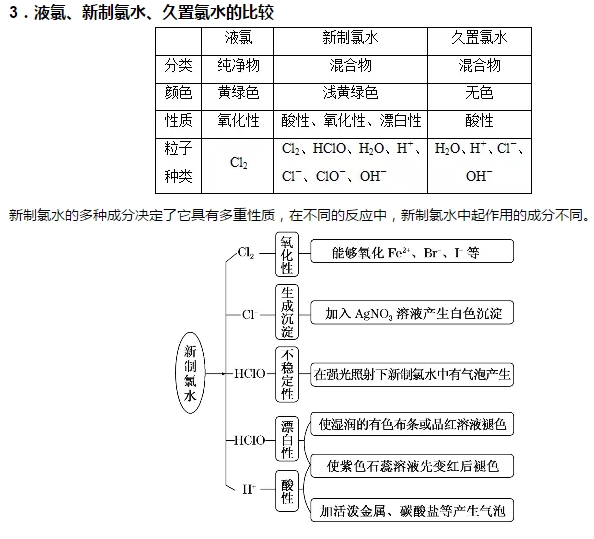 【易错提示】 ①Cl2可使湿润的有色布条褪色,不能使干燥的有色布条褪色,说明Cl2没有漂白性,而是HClO起漂白作用。 ②Cl2可使湿润石蕊试纸先变红后褪色,原因是Cl2与水反应生成的酸使石蕊先变红,HClO使变色后的石蕊褪色。 ③常温下液态氯与铁不反应,故可用钢瓶贮运液氯。 杀菌、消毒的主力军——次氯酸、次氯酸盐   【易错提示】 ①HClO不稳定,不能单独存在,只存在于氯水、次氯酸盐溶液或次氯酸盐与酸反应的混合物中。 ②不能用pH试纸测量氯水的pH,原因是氯水中的HClO具有漂白性。 ③工业上制取漂白粉是用氯气与石灰乳反应制得,而不是用氯气与石灰水反应。 ④“84”消毒液的主要成分为NaClO,漂粉精的有效成分为Ca(ClO)2。“84”消毒液和洁厕灵不能混合使用,其原因是ClO-+Cl-+2H+===Cl2↑+H2O。 氯气的实验室制法 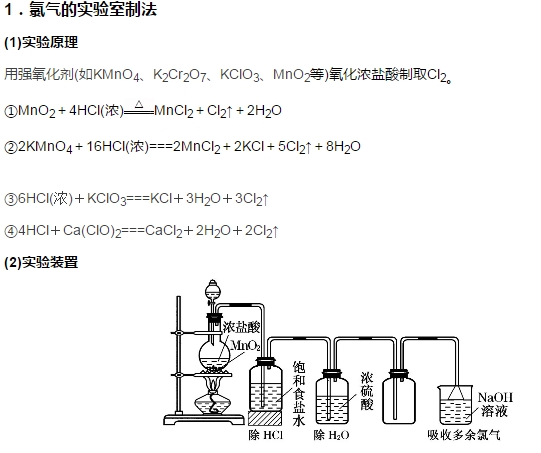 发生装置:固液加热型 净化方法:用饱和食盐水除氯化氢,再用浓硫酸除去水蒸气。 收集方法:向上排空气法或排饱和食盐水法 尾气吸收:用强碱溶液(如NaOH)吸收 (3)验满方法 ①将湿润的淀粉-碘化钾试纸靠近盛Cl2的集气瓶口,观察到试纸立即变蓝,则证明已集满。 ②将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,观察到试纸先变红后褪色,则证明已集满。 ③实验室制取Cl2时,常常根据集气瓶中气体的颜色判断是否收集满。 2.注意事项 (1)必须用浓盐酸,MnO2与稀盐酸不反应。 (2)为了减少制得的Cl2中HCl的含量,加热的温度不宜过高,以减少HCl的挥发。 (3)实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气。 (4)尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全。 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |
