|
高中化学平衡的考点主要集中在以下5个方面,高考化学核心考点临近期中考试赶紧看看。  一、化学平衡的理解及平衡的判定 例1:对可逆反应A2(g)+B2(g)2AB(g)在一定条件下,达到平衡状态的标志是( )。 A.平衡时容器内各物质的物质的量比为1∶1∶2 B.平衡时容器内的总压强不随时间而变化 C.单位时间内生成2n mol AB的同时,生成n mol的B2 D.单位时间内,生成n mol A2的同时,生成n mol的B2 解析:平衡时容器内各物质的物质的量之比是没有规律的,只是各物质的物质的量浓度保持不变是一般规律,A错;对于反应前后气体不变的反应,容器内的总压强不随时间的变化而改变,无论是否平衡!B不能选择;对于C,对于D,如果反应向左进行,单位时间内,本来就是生成n mol A2的同时,一定生成了n mol的B2;对于C,表示反应向左进行的同时也在向右进行,而且程度相同!所以是正确的。答案:C 例2:能够充分说明在恒温恒容下的密闭容器中,反应2SO2+O22SO3已达平衡状态的标志是( )。 A.容器中SO2、O2、SO3的物质的量之比为2∶1∶2 B.SO2 和SO3的物质的量浓度相等 C.反应容器内压强不随时间变化而变化 D.单位时间内生成2 mol SO3 时,即生成1 mol O2 解析:由于题目中没有给出各物质的起始量,也没有给出反应的具体条件,所以无法知道容器中SO2、O2、SO3的物质的量之比为2∶1∶2时,及SO2 和SO3的物质的量浓度相等时反应是否达到平衡,也就是说无法知道达到平衡后,SO2 和SO3 的物质的量浓度上否相等。所以A、B选项不能选为答案。由于此反应是气体非等体积反应,在恒温恒容下,压强不变,说明各物质的浓度不变,故C选项正确。由于单位时间内生成2 mol SO3 时,即消耗了1 mol O2 ,此时又生成1 mol O2,即意味着正反应速率等于逆反应速率,所以D选项也正确。答案:C、D 二、化学平衡的影响因素及勒夏特列原理 例3:(天津卷)对平衡CO2(g)CO2(aq);△H =-19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )。 A.升温增压 B.降温减压 C.升温减压 D.降温增压 解析:增大二氧化碳气体在水中的溶解度,即使平衡向正向移动,而正向为一气体体积减少同时放热,因此可以降低温度,同时还可增大压强。答案:D 特别提醒:改变固本或纯液体的量,化学平衡不移动;恒温、恒容时,通入稀有气体,化学平衡不移动;恒温、恒压时,通入稀有气体,化学平衡向着气体分子数增大的方向移动;加入一种反应物后另一种反应物的转化率会增大,其本身的转化率反而减小;对于等体积反应,改变体系压强对化学平衡无影响。 例4:各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )。 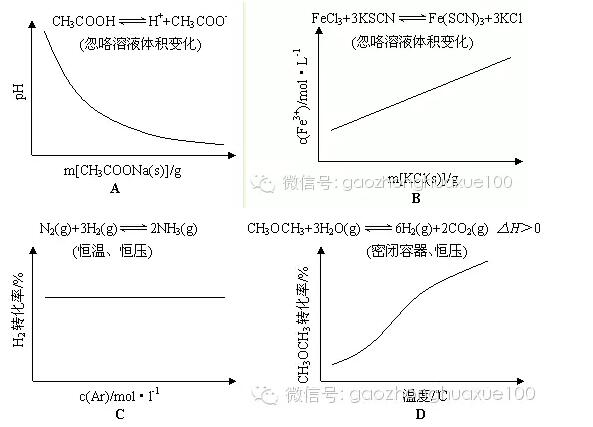 解析: A项CH3COOH溶液中加入CH3COONa固体,CH3COOH溶液中CH3COO—浓度增加,电离平衡逆向移动,c(H+)减小,pH逐渐增大,A错误;B项加入KCl对平衡体系无影响,化学平衡不移动,B错误;C项恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度成倍减小(等效于减压),化学平衡向体积增大的方向移动,H2的改变量减小,起始量不变,转化率减小,C错误2答案:D 三、化学平衡图像 例5:(全国Ⅰ卷)已知:4NH3(g)+5O2(g) = 4NO(g)+6H2(g) △H =—1025 kJ/mol 该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )。 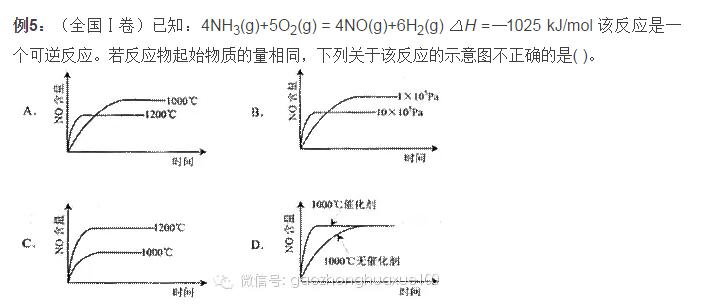 解析:根据“先拐先平,数值大”的原则,选项A、B正确;根据升高温度,平衡向吸热反应方向移动(即逆反应方向移动),可确定A、B正确;根据使用催化剂只能改变化学反应速率,缩短达到平衡的时间,但对化学平衡的移动无影响,所以选项D正确。答案:C 方法技巧:化学平衡经常会以图像来考查,不仅要掌握影响化学平衡的因素及勒夏特列原理,同时还要掌握识图的方法和一些规律,如“先拐先平数值大”和“定一议二”等原则。 例6:气态可逆反应mA(g)+nB(g) pC(g)+qD(g),符合下图,试用“>”或“<”填(1)~(3)题。 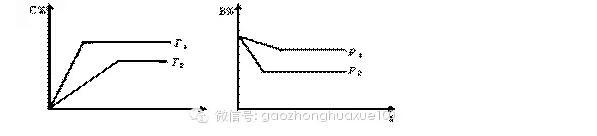 (1)温度T1_________T2 (2)压强p1_________p2 (3)m+n_________p+q (4)正反应为_________反应(填“放热”或“吸热”) 解析:(1)根据“先拐先平,数值大”的原则,T1先出现拐点,说明T1反应温度高,速率快,先达到平衡,故T1>T2。(2)P2先出现拐点,说明P2压强大,反应速率快,先达到平衡,因此P1<P2。(3)根椐右图可知,由P1到P2,压强增大,B%降低。又根据化学反应方程式,B%降低,说明反应向正反应方向移动了,所以,正反应方向是气体体积缩小的方向,故m+n >p+q。(4) 根椐左图可知,由T2到T1,温度升高,C%升高。而由方程式得,C%升高,说明反应向正反应方向移动了,所以正反应方向是吸热方向。 答案:(1)> (2)< (3) > (4)吸热 四、等效平衡规律 例7:在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应: 2A(g)+B(g)3C(g)+D(g)达到平衡时,C的浓度为w mol·L-1,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为w mol·L-1的是( )。 A.4 mol A和2 mol B B.3 mol C +1 mol D +1 mol B C.2 mol A +1 mol B + 3 mol C + 1 mol D D.3 mol C + 1 mol D 解析:根据“C的浓度仍为w mol·L-1”及“维持容器体积和温度不变”知这是等温等容下的等效平衡,故利用极端转化的方法知D符合。答案:D 例8:向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O (g) CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )。 A.0.5 mol CO + 2 mol H2O(g) + 1 mol CO2 +1 mol H2 B.1 mol CO +1 mol H2O(g) +1 mol CO2 +1 mol H2 C.0.5 mol CO +1.5 mol H2O(g) +0.4 mol CO2 +0.4 mol H2 D.0.5 mol CO +1.5 mol H2O(g) +0.5 mol CO2 +0.5 mo H2 解析:题中反应前后气体的体积不变,因此在恒温和恒容条件下是等效平衡的条件是CO和H2O (g)的物质的量之比与起始时加入的CO和H2O (g)的物质的量之比相等即可。因此只要将各个选项中的投料转化为CO和H2O (g)的物质的量,并与原平衡进行对比即可。对于A选项中的配料相当于CO有1.5 mol 、H2O (g)有3 mol,即二者之比为1︰2,所以此情况下的平衡与原平衡等效,即CO的体积分数仍为x;对于B选项中的配料相当于CO有2 mol 、H2O (g)有2 mol,相对于原平衡可以认为是在原平衡的基础上又加入了1 mol CO,相当于平衡向右移动,但是CO的体积分数增大,即大于x; 对于C选项中的配料相当于CO有0.9 mol、H2O (g)有1.9 mol,此投料相当于在0.9 mol CO和1.8 mol H2O (g)的平衡体系中再加入0.1 mol H2O (g),而0.9 mol CO和1.8 mol H2O (g)的平衡与原平衡是等效平衡,再加入0.1 mol H2O (g)时平衡向右移动,CO的体积分数减小,即小于x;对于D选项中的配料相当于CO有1mol、H2O (g)有2 mol,此平衡与平衡相同,所以CO的体积分数也为x。因此达到平衡时CO的体积分数大于x的只有B选项。答案:B 规律总结:定温、定容时:①对于一般的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。②对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,两平衡等效。 五、化学平衡常数和化学平衡计算 例9:A 、B、 C、D为四种易溶物质,它们在稀溶液中建立如下平衡:A+2B+H2OC+D。当加水稀释时,平衡向________(填“正”或“逆”)反应方向移动,理由是___________。 解析:该化学平衡常数Kc=c(C)·c(D)/c(A)·c(B)2,加水稀释后,A 、B、 C、D四种物质稀释相同的倍数,但Qc=c(C)·c(D)/c(A)·c(B)2>Kc ,所以加水稀释后,平衡向逆方向移动。 答案:逆,Qc=c(C)·c(D)/c(A)·c(B)2>Kc 例10:在密闭容器中进行的如下反应:2SO2(g)+O2(g) 2SO3(g)。SO2的起始浓度是0.4 mol/l, O2的起始浓度是1 mol/l,当SO2的转化率为80%时,反应达到平衡状态。 (1)求反应的平衡常数 (2)若将平衡时反应混合物的压强增大1倍,平衡将如何移动? (3)若将平衡时反应混合物的压强减少1倍,平衡将如何移动? (4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡又将如何移动? 解析: 2SO2(g) + O2(g) 2SO3(g) 2 1 2 起始(mol/l) 0.4 1 0 转化(mol/l) 0.4×80% 1/2×0.4×80% 0.32 平衡(mol/l) 0.08 0.84 0.32 平衡常数K=0.322/(0.84 ×0.082)= 400/21;压强增大1倍,各组分的浓度增大1倍;Qc=0.642/(1.68 ×0.162)=200/21<400/21.即Qc<K,所以平衡向正方向移动。同理压强减少1倍,各组分的浓度减少1倍,经过计算Qc>K,所以平衡向逆方向移动。 向平衡混合气体中充入稀有气体Ar,总压增大,但反应混合物中的各组分的浓度不发生改变,所以平衡不发生移动。 答案:(1) 400/21 (2) 平衡向正方向移动 (3) 平衡向逆方向移动 (4) 平衡不发生移动 例11:在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:  请回答下列问题: (1)该反应的化学平衡常数K =_______________ 。 (2)该反应为___________反应。(填“吸热”或“放热”); (3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) = 0.01 mol/L, c(H2O) = 0.03 mol/L, c(CO2) = 0.01 mol/L, c(H2) = 0.05 mol/L ,则反应开始时,H2O的消耗速率比生成速率 _______(填“大”、“小”或“不能确定”); (4)830℃,在1L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为___________, H2的转化率为___________ 。 解析:由平衡常数的定义知该反应的化学平衡常数K的表达K=c(CO)×c(H2O)/c(CO2)×c(H2),可逆反应的平衡常数一般只随温度的改变而改变,吸热反应的平衡常数随温度升高而增大,放热反应的平衡常数随温度升高而减小;由表中数据知该反应随温度的升高而增大,可推知升高温度,平衡向正反应方向移动,所以该反应为吸热反应。把起始浓度代入平衡常数的表达式中,其比值小于800℃时的K值,则反应将向正反应方向移动, H2O的消耗速率比生成速率小;830℃时,平衡常数为1,设反应中转化的CO2浓度为x,则反应过程中物质浓度的变化情况为: CO2(g) + H2(g) CO(g) + H2O(g) 起始 (mol/l) 2 1 0 0 转化 (mol/l) x x x x 平衡 (mol/l) 2-x 1-x x x 据平衡常数的关系可得(2-x) ×(1-x )= x×x,解得x =2/3, 则平衡后CO2的转化率为1/3,H2的转化率为2/3。 答案:(1) K=c(CO)·c(H2O)/c(CO2)·c(H2) (2)吸热 (3)小 (4) 1/3, 2/3 (责任编辑:admin) |
