|
期末考如期而至,但不少学生感觉如临大敌,谈考色变!不知你是否也中枪了?下面小编给大家带来的高二化学选修4第一章化学反应与能量知识点总结,一起来看吧!  考点1:吸热反应与放热反应 1、吸热反应与放热反应的区别 特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。 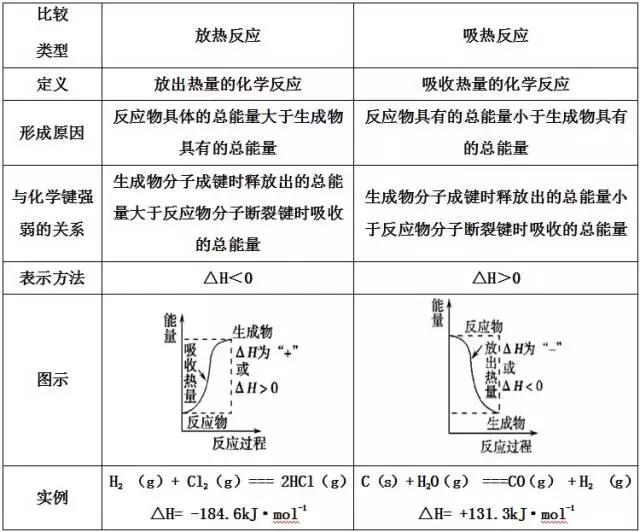 2、常见的放热反应 ①一切燃烧反应; ②活泼金属与酸或水的反应; ③酸碱中和反应; ④铝热反应; ⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。 3、常见的吸热反应 ①Ba(OH)2·8H2O与NH4Cl反应; ②大多数分解反应是吸热反应  考点2:反应热计算的依据 1.根据热化学方程式计算 反应热与反应物各物质的物质的量成正比。 2.根据反应物和生成物的总能量计算 ΔH=E生成物-E反应物。 3.根据键能计算 ΔH=反应物的键能总和-生成物的键能总和。 4.根据盖斯定律计算 化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。 温馨提示: ①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。 ②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。 5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。 (责任编辑:admin) |
