|
高二化学竞赛题 山东五莲一中 隽桂才 一、选择题(共25小题,满分50分) 1、若前20号元素中两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是( )。 A、1 B、3 C、5 D、6 2、含有离子的晶体有( )。 A、分子晶体 B、原子晶体 C、金属晶体 D、以上均不对 3、下列溶液中的c(Cl-)与50 mL 1 mol·L-1氯化铝溶液中的c(Cl-)相等的是( )。 A.150 mL 1 mol·L-1氯化钠溶液 B.75 mL 2 mol·L-1氯化铵溶液 C.150 mL 3 mol·L-1氯化钾溶液 D.50 mL 1 mol·L-1氯化亚铁溶液 4、六“酷似地球经常下雨”,不过“雨”的成份是液态甲烷。下列关于土卫六的说法中,不正确的是( )。 A.土卫六上存在有机分子 B.地表温度极高 C.地貌形成与液态甲烷冲刷有关 D.土卫六上形成了甲烷的气液循环系统 5、只用水就能鉴别的一组物质是( )。 A.苯、乙酸、四氯化碳 B.乙醇、乙醛、乙酸 C.乙醛、乙二醇、硝基苯 D.苯酚、乙醇、甘油 6、27.2 g铁粉和氧化铁的混合物,放入500 mL的稀H2SO4中,发现固体完全溶解,并放出4.48L H2(标况),加入NH4SCN溶液后,无颜色变化,然后向溶液中加入2mol/L NaOH溶液,当溶液呈中性时,用掉NaOH溶液500 mL,则原硫酸溶液的物质质量的浓度为( )。 A.4 mol/L B. 3 mol/L C. 2 mol/L D. 1 mol/L 7、在一定温度下,向饱和硫酸钠溶液中加入a克无水硫酸钠粉末,搅拌、静置后,析出b克Na2SO4·10H2O,则b-a的值是( )。 A.原饱和溶液失去水的质量 B.原饱和溶液中减少的硫酸钠的质量 C.原饱和溶液中失去水和硫酸钠的质量 D.析出晶体含有水的质量 8、向10 mL 0.1mol/L的硫酸铜溶液中加入10 mL 0.15 mol/L的氢氧化钠溶液时,产生一种蓝色沉淀,经测定溶液中的铜离子已几乎被沉淀完全。该沉淀的主要成分是( )。 A、Cu(OH)2 B、3Cu(OH)2·CuSO4 C、Cu2(OH)3 D、Cu2(OH)2SO4 9、盛满NO2和N2的混合气体,将其倒立在水槽中,反应完全后水面上升的高度为试管高度的1/3,则原试管中NO2和N2的体积比为( )。 A.1∶1 B.2∶1 C.3∶1 D.3∶2 10、25 ℃时,浓度为0.1 mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性。下列判断一定正确的是( )。 A、HA酸溶液的pH值一定等于1 B、HA酸溶液的物质的量浓度一定等于0.1 mol/L C、中和后溶液中M+离子浓度一定等于A-离子浓度 D、中和后生成的盐MA一定没有发生水解 11、各0.1 mol的CH3COOH和CH3COONa配成1 L混合溶液,已知其中[CH3COO-]>[Na+]。则下列判断正确的是( )。 ①[H+]>[OH-] ②[CH3COOH]+[CH3COO-]=0.2 mol/L ③[CH3COOH]>[CH3COO-] ④[CH3COO-]+[OH-]=0.1 mol/L A. ①② B.①③ C. ②④ D. ③④ 12、下列情况能通过置换反应得到铁的是( )。 A、铜与氯化亚铁常温下混和 B、一氧化碳通过灼热的三氧化二铁 C、氢气通过硫酸亚铁溶液 D、铝和四氧化三铁混合加热至高温 13、美国“9·11”恐怖袭击事件给纽约带来了一场严重的环境灾难——石棉污染,易使吸入石棉纤维者患肺癌,已知石棉是硅酸盐矿物,某种石棉的化学式可表示为Ca2MgxSiyO22(OH)2,则x、y的值分别为( )。 A. 8,3 B. 5,8 C. 3,8 D. 5,5 14、用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体, 实验过程如图所示,下列叙述正确的是( )。 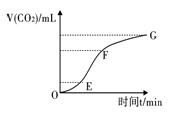 A. OE段化学反应速率最快 B. EF段化学反应速率最快 C. FG段收集的二氧化碳气体最多 D. 由图可推断出该反应是吸热反应 15、某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是( )。 A. KMnO4 B. NaCl C. (NH4)2SO4 D. CH3COOH (05MCE2.12) 16、用坩锅钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是( )。 A.火焰温度太低不能使铝燃烧 B.铝在空气种能很快形成氧化膜 C.氧化铝的熔点比铝的熔点高 D.用酸处理时未能将氧化铝溶解 17、如图所示,下列叙述正确的是( )。 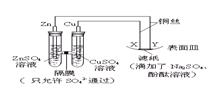 A、Y为阴极,发生还原反应 B、X为正极,发生氧化反应 C、Y与滤纸接触处有氧气生成 D、X为滤纸接触处变红 18、下图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )。  A.反应达平衡时,正反应速率和逆反应速率相等 B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动, 达到平衡态II D.同一反应物在平衡态I和平衡态II时浓度不相等 19、锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为( )。 负极反应:C6Li-xe-==C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料) 正极反应:Li1-xMO2+xLi++x e-==LiMO2(LiMO2表示含锂的过渡金属氧化物) 下列有关说法正确的是( ) A.锂离子电池充电时电池反应为C6Li+Li1-xMO2==LiMO2+C6Li1-x B.电池反应中,锂、锌、银、铅各失去4mol电子,金属锂所消耗的质量最小 C.锂离子电池放电时电池内部Li+向负极移动 D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-==C6Li 20、将一定量的饱和的一元醇分成两等份将其中一份完全燃烧,消耗28.8 g氧气,在另一份中加入过量金属钠,产生2.24L(标准状况)H2,则醇是( )。 A.甲醇 B.乙醇 C.丙醇 D.丁醇 21、有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是( )。 A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 B.乙烯能发生加成反应,乙烷不能发生加成反应 C.甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 22、萘环上的碳原子的编号如(I)式,根据系统命名法,(Ⅱ)式可称为2一硝基萘,则化合物(Ⅲ)的名称应是( )。 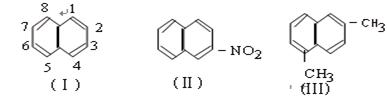 A.2,6一二甲基萘 B.1,4一二甲基萘 C.4,7一二甲基萘 D.1,6一二甲基萘 23、有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占的体积相同,则甲可能结构有( )。 A.8种 B.14种 C.16种 D.18种 24、分子式为C5H10O3的有机物,在一定条件下能发生如下反应:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在特定温度及浓硫酸存在下,能生成一种能使溴水褪色的物质;③在特定温度及浓硫酸存在下,还能生成一种分式为C5H8O2的五元环状化合物。则C5H10O3的结构简式为( )。 A.HOCH2CH2COOCH2CH3 B.HOCH2CH2CH2CH2COOH C.CH3CH2CH(OH)CH2COOH D.CH3CH(OH)CH2CH2COOH 25、设NA为阿伏加德罗常数,下列叙述中不正确的是( )。 A. pH=1的甲酸溶液中,HCOO-和H+ 数目之和为0.1 NA B. 标准状况下,3.36 L乙烯中含有的非极性键数为0.30 NA C. 1 mol甲基(-CH3)所含电子数9NA D. 1 mol油酸含有的双键数目约为3.01×1023 二、非选择题(共50分) 26、(6分)某一元羧酸A,含碳的质量分数为50%,氢气、溴、溴化氢都可以跟A起加成反应。试求: (1)A的分子式________________________________ (2)A的结构简式_______________________________ (3)写出推算过程___________________________________ 答案:(1)A是一元羧酸,所以A有—COOH,A能与氢气、溴、溴化氢反应,所以分子中有碳碳不饱和键。含碳碳不饱和键的最简单化合物是丙烯酸和丙炔酸,但只有丙烯酸的碳的质量分数为50%。所以A是丙烯酸。 27、(3分)某烷烃碳架结构如图所示:  ,此烷烃的一溴代物有______ 种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为 ,若此烷烃为单烯烃加氢制得,则此烯烃的结构有 种。 ,此烷烃的一溴代物有______ 种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为 ,若此烷烃为单烯烃加氢制得,则此烯烃的结构有 种。28、(14分)目前工业上主要采用离子交换膜法电解饱和食盐水,制得Cl2和H2,并以获取的气体来产生盐酸。将电解后所得的Cl2和H2按一定体积比,按图示流程合成质量分数为36.5%的盐酸。 H2和Cl2→ 合成炉 → 石墨冷凝器 → 一级干燥塔 → 二级干燥塔 → 吸收塔 (1)写出电解饱和食盐水的化学方程式 。 (2)已知工艺条件下食盐的溶解度为36.5 g,则该温度下饱和食盐水溶质的质量分数为 。 (3)设每台电解槽平均每天消耗2.3×104mol食盐,电解生成的Cl2与H2按体积比1:1.15通入合成塔,不考虑各阶段的物料损耗,理论上可生产36.5%的盐酸 t。 (4)某厂现有相同的电解槽n台,每台每天消耗食盐a t,氯气与氢气以1:b(b>1)通入合成炉,不考虑各阶段的物料损耗,则该厂每天生产36.5%的盐酸m t。则m= t。 解析:此题为以具体工业生产为背景的关系式法计算题 ⑴ 2NaCl+ 2H2O  2NaOH + H2↑+ Cl2↑ 2NaOH + H2↑+ Cl2↑⑵w(NaCl)=  = 26.8% = 26.8%⑶由方程式可知每消耗2.3×104 mol食盐,可生成1.15×104 mol Cl2与1.15×104 mol H2,Cl2与H2按体积比1:1.15通入合成塔,所以参加反应的Cl2与H2均为104 mol,生成HCl为2×104 mol,质量为7.3×105 g,可生产36.5%的盐酸2 t。 ⑷与⑶解法相似。 答案:(1) 2NaCl+ 2H2O  2NaOH + H2↑+ Cl2↑(2分) 2NaOH + H2↑+ Cl2↑(2分)(2)26.8% (4分) (3)2.0t (4分) (4)  (4分) (4分)29、(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图: (注意:其中有些反应的条件及部分生成物被略去)  请填写下列空白: (1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为 。 (2)从D溶液制备D的无水晶体的“操作a”为 。 (3)反应②的化学方程式为 。 (4)反应⑤的化学方程式为 。 (5)原电池反应①中正极的电极反应式为 。 29、答案:(1)2Mg+CO2===2MgO+C; (2分) (2)将D溶液在HCl气流中蒸干;(2分) (3)②4NH3+5O2  4NO+6H2O; (2分) 4NO+6H2O; (2分)(4)⑤C+4HNO3(浓) (5)2NH4++2e- = 2NH3↑+H2↑ (2分) 30、(17分)为省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白: ⑴甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫 酸,观察到的现象是 。甲同学的设计思路 是 。 ⑵乙同学接着甲的实验,向烧杯中滴加 溶液,进而观察到的现象是 , 。乙同学作出锌、铜金属活动性相对强弱所依据的原理是 , 。 ⑶丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的 试剂(作为电解液)。反应在调控下随即开始,实验中有关化学反应方程式 为 。获得的实验明显现象是 。 ⑷请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌和铜的金属活动性的 相对强弱(简要说明操作和现象) 。 30、答案:(1)锌片上有气泡产生,铜片上无气泡。(2分) 锌能置换出酸中的氢而铜不能。(2分) (2)CuSO4溶液。锌片上有红色铜析出,锌片上产生气泡的速率明显加快。活泼金属可不活泼金属从其盐溶液中置换出来,Zn、Cu,稀硫酸组成原电池,Zn为负极。(每线1分) (3)2CuSO4 + 2H2O  2Cu + O2↑+ 2H2SO4 (2分),阴极上有红色铜析出。(2分) 2Cu + O2↑+ 2H2SO4 (2分),阴极上有红色铜析出。(2分)(4)分别取一小片铜片与锌片于试管中,向试管中加入少量的棕黄色的溶液,稍待,溶液的棕黄色褪去得一近乎无色溶液。(4分) 三、附加题(8 分) 31、(8分)有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21 g该晶体溶于水,配成100 mL溶液,将此溶液用石墨作电极进行电解,当有0.01 mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.32 g。求: (1)金属M的相对原子质量及x、y。 (2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)答案(1)64;2 ;3(2) 1 下载: (责任编辑:admin) |
