|
《来自石油和煤的两种基本化工原料》同步测试(第1课时) 贵州省遵义市第二中学 周厚彬 一、选择题 1.从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是( ) A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟而腐烂 D.利用高锰酸钾溶液的氧化性,催熟水果 考查目的:考查乙烯的用途。 答案:C 解析:长途运输水果时往往会释放乙烯气体,乙烯是水果催熟剂,容易造成水果早熟甚至腐烂、霉变,将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,利用高锰酸钾溶液的氧化性吸收水果产生的乙烯可防止水果早熟。 2.下列关于烷烃和烯烃的说法中不正确的是 ( ) A.它们所含元素的种类相同,但通式不同 B.均能与氯气发生反应 C.烯烃分子中的碳原子数≥2,烷烃分子中的碳原子数≥1 D.含碳原子数相同的烯烃和烷烃互为同分异构体 考查目的:考查烷烃和烯烃的性质性质、保护程度、通式对比及同分异构体概念。 答案:D 解析:烷烃的通式为CnH2n+2,烯烃的通式为CnH2n,所含元素种类相同,通式不同;烷烃可以与Cl2发生取代反应,烯烃可以与Cl2发生加成反应;烷烃中最简单的为CH4,烯烃中最简单的为C2H4;碳原子数相同的烷烃和烯烃,由于饱和程度不同,氢原子数不同,不属于同分异构体。 3.某气态的烷烃与烯烃的混合气体9g,其密度为同状况下H2密度的11.2倍,将混合气体通过足量的溴水,溴水质量增加4.2g,则原混合气体的组成为( ) A.甲烷、乙烯 B.乙烷、乙烯 C.甲烷、丙烯 D.甲烷、丁烯 考查目的:考查平均相对分子质量的计算,烯烃的性质和混合物组成的判断。 答案:C 解析:已知r=11.2×2=22.4,则n(混)==0.4mol,且28>r=22.4>16,所以混合气体中烷烃必为CH4,且n(CH4)==0.3mol,则n(烯)=0.4mol-0.3mol=0.1mol,M(烯)==42g·mol-1=14n,所以n=3,即烯烃为C3H6。 4.1mol某烃完全燃烧后,能生成二氧化碳112L(标准状况下),此烃在一定条件下能与氢气加成,最多能消耗两倍于其体积的氢气,则此烃的结构简式可能为( ) 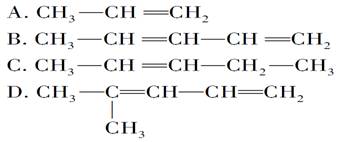 考查目的:考查加成反应。 答案:B 解析:由题意,该烃与氢气加成时,最多消耗氢气的体积为该烃体积的2倍,由此可知该烯烃分子中含2个碳碳双键,故排除A和C。由1mol该烃燃烧生成CO2的物质的量为5mol,可知该烃分子中含5个碳原子,故正确答案为B。 5.下列有关乙烯的说法,其中错误的是( ) A.乙烯分子的双键中有一个键较易断裂 B.乙烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为120° C.乙烯的化学性质比乙烷活泼 D.乙烯和环丙烷( 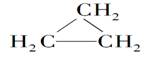 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物考查目的:考查乙烯的性质和结构。 答案:D 解析:乙烯和环丙烷分子式相同,结构不同,一个是链状且存在C===C,一个是环且只由C—C单键构成,不是同系物,故选D。 6.分子式为C6H12,分子中具有3个甲基的烯烃共有( ) A.2种 B.3种 C.4种 D.5种 考查目的:考查同分异构体的书写。 答案:D 解析:两端用去2个甲基,第三个CH3—位于支链上,主链为5个碳原子,有以下几种: 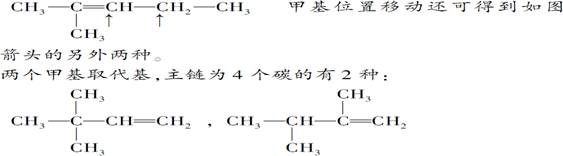 7.下列烯烃和HBr发生加成反应所得产物有同分异构体的是( ) A.CH2===CH2 B.CH3CH===CHCH3 C.(CH3 )2C===C(CH3 )2 D.CH3CH2CH===CH2 考查目的:考查烯烃的性质,能发生加成反应,是否有对称性和同分异构体现象。 答案:D 解析:A、B、C选项中烯烃属于对称烯烃,分子中两个不饱和碳原子位置是等同的,因此和HBr加成时所得产物没有同分异构体,而D选项中烯烃属于不对称烯烃,即分子中两个不饱和碳原子位置是不等同的,故加成后可得两种产物。 8.将29.5g乙烷和乙烯的混合气体通入足量的溴水后,溴水质量增加7g,则混合气体中乙烯的体积分数是( ) A.21% B.25% C.30% D.35% 考查目的:考查烷烃和烯烃的性质对比和计算。 答案:B 解析:乙烷不与溴水反应,乙烯可与Br2发生加成反应,因此溴水质量增加是因为吸收了乙烯,故n(C2H4)==0.25mol,则n(C2H6)==0.75mol,相同条件下气体体积之比等于其物质的量之比,因此混合气体中C2H4的体积分数为×100%=25%。 9.将1.0体积乙烷和乙烯的混合气体在氧气中充分燃烧,生成2.0体积的CO2和2.4体积的水蒸气(同温同压下测定)。则混合物中烷烃和烯烃的体积比为( ) A.3:1 B.1:3 C.2:3 D.3:2 考查目的:考查阿伏伽德罗定律和质量守恒定律及烃的性质。 答案:C 解析:同温同压下气体的体积之比等于其物质的量之比。由题意1mol乙烷和乙烯的混合气体充分燃烧生成2mol CO2和2.4mol H2O,根据质量守恒定律,1mol乙烷和乙烯中的碳原子的物质的量等于2mol CO2中碳原子物质的量,氢原子的物质的量等于2.4mol H2O中氢原子的物质的量。设乙烷(C2H6)的物质的量为x,则乙烯(C2H4)的物质的量为1-x,且:6x+4(1-x)=2.4×2,x=0.4,1-x=0.6。烷烃和烯烃的体积比为0.4:0.6=2:3。 10.(体验高考)煤、石油、天然气是重要的能源和化工原料,下列说法正确的是 A.石油裂解得到的汽油是纯净物 B.石油产品都可用于聚合反应 C.水煤气是通过煤的液化得到的气态燃料 D.天然气是清洁燃料 考查目的:考查煤、石油、天然气的用途和有关性质。 答案:D 解析:汽油是一种碳原子数为5~8的烃组成的混合物,石油产品中只有含有不饱和键的烃 才能用于聚合反应,故A、B选项均错误;水煤气是通过煤的气化得到的气体燃料。 二、非选择题 11.实验室中通常用加热无水乙醇与浓硫酸的混合物的方法制取乙烯,浓硫酸是乙醇反应的催化剂和脱水剂。在具体的化学实验中常因加热的温度过高导致副反应发生而使乙烯气体中混有二氧化硫气体。下图所表示的装置可以用于确认乙烯气体中混有二氧化硫气体。可选择的化学试剂有: 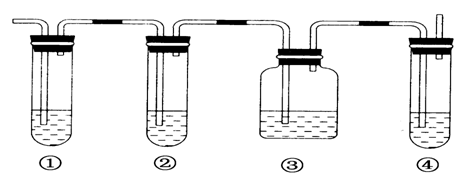 A.品红溶液 B.烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液 回答下列问题: (1)由乙醇生成乙烯的化学反应方程式是______________,该化学反应所属的类型可以是________或________。 A.取代反应 B.加成反应 C.脱水反应 D.分解反应 (2)图中①、②、③、④的容器内盛放的化学试剂分别是(填写代号) ①________、②________、③________、④________。 (3)能说明二氧化硫气体存在的现象是____________________。 (4)使用装置②的目的是________________;使用装置③的目的是________________。 (5)确认乙烯气体存在的现象是 __________________________。 (6)实验室中可以采用将乙烯气体通入酸性高锰酸钾溶液的实验方法证明乙烯具有容易被氧化的化学性质。在将乙烯气体通入酸性高锰酸钾溶液之前要进行的一项实验是___________。 考查目的:考查乙烯的制取和性质,意在考查对仪器用途(除杂、干燥、检验)的识别能力,实验现象的描述,实验操作能力及有关反应原理的理解情况 答案:(1)CH3—CH2—OH浓硫酸170℃CH2===CH2↑+H2O C D;(2)①A ②B ③A ④D (3)①中品红溶液褪色;(4)除去二氧化硫 帮助判断二氧化硫是否除尽 (5)③中品红溶液不褪色,④中酸性高锰酸钾溶液褪色;(6)除去乙烯中的二氧化硫 解析:加热无水乙醇与浓硫酸的混合物即生成乙烯,浓硫酸的作用是乙醇反应的催化剂和脱水剂,化学方程式为:CH3—CH2—OH浓硫酸170℃CH2===CH2↑+H2O,由“浓硫酸的作用是乙醇反应的催化剂和脱水剂”和“反应生成水”的信息可知,该化学反应属于脱水反应。该化学反应又是由一种物质生成两种物质的反应,所以它又属于分解反应。从解答本题的角度来说,乙烯和二氧化硫的性质的相同点是都能使酸性高锰酸钾溶液褪色,不同点是二氧化硫能使品红溶液褪色而乙烯不能;二氧化硫能溶于烧碱溶液而乙烯不能。所以应该先确定二氧化硫的存在后再确定乙烯的存在。二氧化硫使品红溶液褪色的灵敏度很高,品红溶液对二氧化硫的吸收量很小,所以在确定了二氧化硫的存在以后,还要除去二氧化硫并检验二氧化硫是否除尽。 12.(体验高考)2-丁烯是石油裂解的产物之一,回答下列问题: (1)在催化剂作用下,2-丁烯与氢气反应的化学方程式为 ,反应类型为 。 (2)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 ;A分子中能够共平面的碳原子个数为 ,A与溴的四氯化碳溶液反应的化学方程式为 。 考查目的:考查有机物的组成、结构、性质、同分异构体、有机反应化学方程式的书写和反应类型,意在考查考生运用相关知识解决问题的能力。 答案:(1)CH3CH=CHCH3+H2 (2) 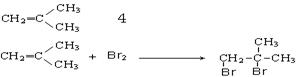 解析:(2)A加氢后不生成正丁烷,可判断其碳链有支链,结构只能是一种,4个碳原子均在碳碳双键形成的平面上。 (责任编辑:admin) |
