|
元素周期表(第四课时 习题) 1.化学变化中,可能发生改变的是( )。 A.质子数 B.中子数 C.核外电子数 D.原子核 2.元素原子中,质子数与中子数的关系是( )。 A.前者大 B.后者大 C.相等 D.不能确定 3.决定原子种类的是( )。 A.质子数 B.电子数 C.中子数 D.质子数中子数 4.下列各微粒中,具有相同核外电子数的是( )。 A.11Na+ 和11Na B.20Ca2+ 和19K+ C.11Na+ 和12Mg2+ D.14N和14C 5.下列关于 A.质子数为39 B.中子数为20 C.电子数为39 D.质量数为39 6.下列原子核内中子数最多的是( )。 A. 7.同温同压下,1mol Ar和1mol F2具有相同的( )。 A.质子数 B.质量 C.原子数 D.体积 8.下列微粒:①质子 ②中子 ③电子,在所有原子中均含有的微粒是( )。 A.①②③ B.① C.①③ D.①② 9.对Fe3+、Fe2+、Fe三种微粒的判断不正确的是( )。 A.核电荷数相同 B.质量不相等 C.属于同一种元素 D.核外电子数相同 10.某+3价金属阳离子,具有28个电子,其质量数为70,那么它的核内中子数是( )。 A.28 B.21 C.39 D.42 11.某元素的阳离子Rn+,核外共有x个电子,原子的质量数为A,则该元素原子里的中子数是( )。 A.A-x-n B.A-x+n C.A+x-n D.A+x+n 12.X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素的原子序数),下列关系正确的是( )。 A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m 13.在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含的中子数为( )。 A.A-x+n+48 B.A-x+n-24 C.A-x+n+24 D.A-x-n 14.下列几组物质中,互为同位素的是( )。 A.Ca和 15.同温同压下,等体积的两密闭集气瓶中分别充满12C18O和14N2两种气体。关于这两个容器中气体的说法正确的是( )。 A.质子数相等,质量不等 B.分子数和质量分别不相等 C.分子数和质量分别相等 D.原子数、中子数和质子数都分别相等 16.核外电子层结构相同的一组粒子是( )。 A.Mg2+、Al3+、Cl-、Ne B.Na+、F-、S2-、Ar C.K+、Ca2+、S2-、Ar D.Mg2+、Na+、Cl-、S2- 17.若某氖原子的质量是ag,12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法不正确的是( )。 A.氖原子的相对原子质量是12a/b B.Wg该氖原子的物质的量一定是W/(aNA)mol C.该氖原子的摩尔质量是aNAg D.Wg该氖原子含的质子数是10W/a 18.X元素原子的最外层电子数与次外层电子数的差值等于电子层数;Y元素的原子比X元素的原子多2个最外层电子,则X与Y所形成的化合物为( )。 A.X3Y2 B.X2Y C.XY2 D.X2Y3 19.下列叙述正确的是( )。 A.核外电子排布相同的两种粒子其化学性质一定相同 B.质子数和电子数均相同的阳离子和阴离子是不存在的 C.所有原子都是由质子、中子和电子构成的 D.质子数相同的粒子,其核外电子排布也相同 20.下列叙述中正确的是( )。 A.氢元素形成的离子就是一个质子 B.钙原子结构示意图为  C.最外电子层上排有8个电子的微粒一定是稀有气体元素的原子 D.核内质子数和核外电子数均相同的微粒不一定是同种元素的原子 21.用A.质子数 B.中子数 C.核外电子 D.最外层电子数 E.电子层数 填写下列各空(填代号): (1)原子种类由_________决定; (2)元素种类由_________决定; (3)元素的化合价主要由_________决定; (4)元素的化学性质主要由_________决定; (5)核电荷数由__________________决定。 22.下列微粒都具备有10个电子,请写出它们的化学式 (1)含一个原子核的二价阳离子_________(2)含两个原子核的分子_________ (3)含两个原子核的一价阴离子_________(4)含五个原子核的分子_________ (5)含五个原子核的一价阳离子_________ 23.从图中选出符合题意的各粒子的结构简图。(填代号) 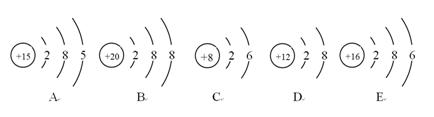 (1)质量数为31,质子数比中子数少1的原子( )。 (2)电子排布与Ar相同的正二价简单阳离子( )。 (3)最外层电子数是次外层电子数3倍的原子( )。 (4)电子排布与Ne相同,质子数比电子数多2个的粒子( )。 (5)L层电子数等于其它层电子数之和的原子( )。 24.A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。 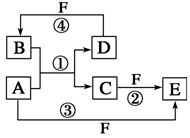 (1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为__________。 (2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是______________________________,已知光照条件下D与F反应生成B,写出该反应的化学方程式:_____________________________。 (3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________。 答案 (1) (2)2Fe2++Cl2===2Fe3++2Cl- H2+Cl22HCl (3)2C+SiO2Si+2CO↑ (责任编辑:admin) |
