|
元素周期表(第三课时 学案) 【学习目标】 1.了解卤族元素在周期表中的位置及原子结构的特点。 2.了解卤素单质的物理性质和化学性质。 【目标一】卤族元素的原子结构及特点 (1)原子结构示意图: (2)相同点:_________________________________,不同点:核电荷数不同,____________不同、___________不同。 (3)递变性:随着核电荷数的增加,卤族元素原子的电子层数逐渐_______,原子半径逐渐_________,原子核对最外层电子的吸引力逐渐_________。 【导思】 由F、Cl、Br、I的原子结构推测它们得失电子能力的异同? _________________________________ 【目标二】物理性质(单质)
【目标三】化学性质 (1)与H2反应 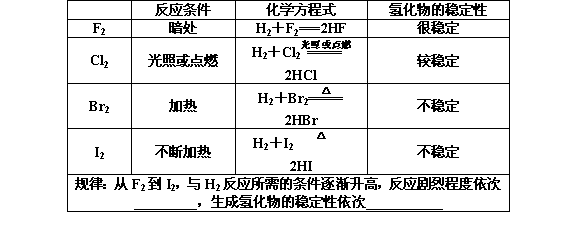 (2)卤素单质间的置换反应
【导思】 请写出两个离子方程式以证明氧化性强弱为:Cl2>Br2>I2。 ________________________ ________________________ 【合作探究】 要点一 卤素单质的性质的相似性、递变性和特性 1.相似性 ① 与H2反应________________________________ ② 与活泼金属(如钠)反应___________________ ③ 与水反应_________________________________ 2.递变性 (1)氧化性与还原性  (2)与H2反应的难易及氢化物稳定性(由F2→I2) ①与H2反应越来越难,生成的氢化物的稳定性逐渐减弱,还原性逐渐增强。 ②氢化物中HCl、HBr、HI的熔、沸点依次升高。 (3)卤素单质与变价金属(如Fe)反应 2Fe+3X2=2FeX3?(X=F、Cl、Br)? Fe+X2=FeX2?(X=I?) 3.卤素单质的特殊性质 (1)Br2在常温下是惟一的液态非金属单质,易挥发。 (2)碘为紫黑色固体,易升华,淀粉遇I2变蓝色。 【规律总结】 卤族元素单质及其化合物的性质总结 (1)按由F→I的顺序元素的非金属性逐渐减弱 (2)氢化物稳定性:HF>HCl>HBr>HI (3)氢化物还原性:HF<HCl<HBr<HI (4)最高价含氧酸酸性:HClO4>HBrO4>HIO4,F无正价,故无含氧酸。 (5)密度:卤族元素,自上至下,单质密度逐渐增大。 (6)熔、沸点:卤族元素同碱金属相反,自上至下,单质熔、沸点逐渐升高。 (7)溶解性:除F2外,卤素单质在水中的溶解性均不大,均易溶于有机溶剂。 要点二 非金属性强弱的判断 比较元素非金属性的强弱,其实质是看元素原子得电子的难易程度,越易得电子,非金属性越强。 1.从元素原子结构判断 (1)当电子层数相同时,核电荷数越多,非金属性越强。 即:同周期,自左至右,元素非金属性增强。 (2)当最外层电子数相同时,核电荷数越多,非金属性越弱。即:同主族,自上至下,元素非金属性减弱。 2.从元素单质及其化合物的相关性质判断 (1)单质越易跟H2化合,生成的氢化物也就越稳定,氢化物的还原性也就越弱,其非金属性也就越强。 (2)最高价氧化物对应水化物的酸性越强,其非金属性越强。例如:H2SO4的酸性强于H3PO4,说明S的非金属性比P强。 (3)非金属单质间的置换反应。例如:Cl2+2KI===2KCl+I2,说明氯的非金属性比碘强。 (4)元素的原子对应阴离子的还原性越强,元素的非金属性就越弱。例如:S2-的还原性比Cl-强,说明Cl的非金属性比S强。 【强调】(1)金属性和非金属性讨论的对象是元素,具体表现为该元素的单质或特定化合物的性质。 (2)氧化性和还原性讨论的对象是具体物质或某物质中的特定粒子,具体表现在该物质中某元素得失电子的能力。 【导练】 1.氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )。 A.单质的密度依次增大(Br2除外) B.单质的熔、沸点依次升高 C.Cl2可从KI溶液中置换出I2 D.F2可以从NaCl溶液中置换出Cl2 2.下列关于卤族元素由上到下性质递变的叙述,正确的是( )。 ①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强 A.①②③ B.②③④ C.②④⑤ D.④⑤ 3.X、Y是元素周期表ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )。 A.X原子的电子层数比Y原子的电子层数多 B.Y的单质能将X从NaX的溶液中置换出来 C.X的单质比Y的单质更容易与氢气反应 D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强 (责任编辑:admin) |
||||||||||||||||||||||||||||||||||



