|
元素周期表(第四课时 学案) 【学习目标】 1.了解核素和同位素的概念及原子的表示方法。 2.了解核外电子排布规律 【目标一】原子:原子是________________中最小的微粒。 1.原子的构成是怎样的? 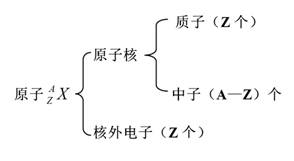 原子内各微粒:
结论:①原子的质量主要集中在__________上,原子核的__________极大,原子的质量主要由__________和__________的质量决定。 【目标二】离子 (1)阳离子:原子__________电子后所形成的微粒。阳离子的核外电子数=质子数__________。 (2)阴离子:原子__________电子后所形成的微粒。阴离子的核外电子数=质子数__________。 一般说来,原子形成阳离子后半径__________,原子形成阴离子后半径__________。 (3)粒子之间的数量关系: 原子:核电荷数=质子数=核外电子数 阳离子:核电荷数=质子数=核外电子数+电荷数 阴离子:核电荷数=质子数=核外电子数-电荷数 【目标三】核素 1.原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似__________相加,所得的数值叫做_________。 质量数(A)=__________(Z)+__________(N)。 2.把具有一定数目质子和一定数目中子的一种原子称为________。一种原子即为一种核素。 质子数相同而__________不同的同一元素的不同原子互称为__________。 例如,1H、2H、3H是三种不同的________,它们互为_________,它们都属于氢元素。 【导思】 为何原子的种类大于元素的种类? 【导练】 1.医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病(AIDS)。关于14C的下列说法中正确的是( )。 A.14C原子与C60中普通碳原子的化学性质不同 B.14C原子与14N原子所含中子数相同 C.与C60是同种元素构成的不同单质 D.与12C、13C是碳元素的三种同位素 【合作探究】 元素、核素、同位素、同素异形体的区别和联系: 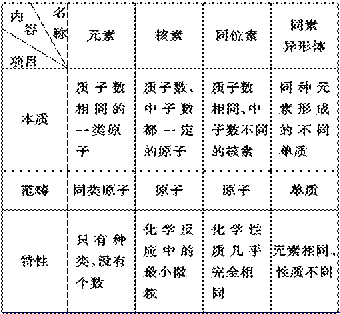 【强调】 ⑴在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。 ⑵同种元素可以有多种不同的同位素原子,所以元素的种类数目远少于原子种类的数目。 ⑶自然界中,元素的各种同位素的含量基本保持不变。 【导练】 2、我国稀土资源丰富,下列有关稀土元素144 62Sm与150 62Sm的说法正确的是( )。 A.144 62Sm与150 62Sm互为同位素 B.144 62Sm与150 62Sm的质量数相同 C.144 62Sm与150 62Sm是同一种核素 D.144 62Sm与150 62Sm的核外电子数和中子数均为62 【目标四】原子核外电子排布 1.核外电子运动的特点是: (1)质量很小(9.1095×10-31千克),带负电荷; (2)运动的空间范围小; (3)速度很快。 由于以上原因,核外电子的运动规律与宏观世界物体不同,它没有确定的轨道,我们不能测定或计算它在某一时刻的位置,也不能描述它的运动轨迹。我们只能指出它在空间某处出现机会的多少。 2.电子层:根据电子能量的高低和离核的远近把核外电子运动的不同区域划分成不同的电子层,电子层的划分如下:
3.核外电子的排布规律: ①各电子层最多容纳的电子数为2n2;
②最外层不超过8个(K层为最外层时不超过2个); ③次外层电子数不超过18个,倒数第三层电子数不超过32个; ④能量最低原理:核外电子总是尽先排布在能量最低的电子层里(离核越近),然后由里往外,依次排布在能量较高的电子层里(离核越远)。 【规律总结】 1、常见2e-的简单离子:Li+、Be2+、H-。 2、核外有10个电子的粒子: (1)分子:CH4、NH3、H2O、HF、Ne。 (2)阳离子:Na+、Mg2+、Al3+、NH、H3O+。 (3)阴离子:N3-、O2-、F-、OH-、NH。 3、常见18e-的粒子: (1)分子:SiH4、PH3、H2S、HCl、H2O2、N2H4、C2H6、CH3OH。 (2)阳离子:K+、Ca2+。 (3)阴离子:S2-、Cl-。 【概念辨析】 1.原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。如一个氧原子的真实质量是2.657×10-26Kg。 2.相对原子质量:以12C原子的质量的1/12(约1.66×10-27 kg  3.质量数和原子的相对原子质量是不同的,质量数一定是整数,而相对原子质量一般不是整数,质量数有时可看作近似相对原子质量。 (责任编辑:admin) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
