|
氧化还原反应 习题 河北武邑中学 李宗建 1.化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。下列变化属于氧化还原反应,但不属于四种基本反应类型的是( ) ①CO+CuOCO2+Cu ②2Al+Fe2O3Al2O3+2Fe ③2O33O2 ④Cl2+2FeCl2===2FeCl3 A.①② B.②③ C.① D.③④ 2.下列说法正确的是( ) A.阳离子只有氧化性,阴离子只有还原性 B.失电子难的原子获得电子的能力一定强 C.得到电子越多的氧化剂,其氧化性就越强 D.要实现Fe2+ 3.下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( ) A.F2、K、HCl B.Cl2、Al、H2 C.NO2、Na、Br2 D.O2、SO2、H2O 4.如图 (b)的碎纸片补充到图(a)中,可得到一个完整的离子方程式。对该离子方程式说法正确的是( ) 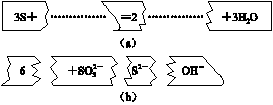 A.配平后的化学计量数依次为3、1、2、6、3 B.若有1 mol的S被氧化,则生成2 mol S2- C.氧化剂与还原剂的物质的量之比为1∶2 D.2 mol的S参加反应有3 mol的电子转移 5.已知下列物质氧化H2SO3时,自身发生如下变化:Cl2→2Cl-,MnO4-→Mn2+ ,Cr2O72-→2Cr3+, H2O2→2H2O。如果分别用等物质的量的这些物质氧化足量的H2SO3,得到H2SO4最多的是 A.Cr2O72- B.Cl2 C.MnO4- D.H2O2 6.在一定条件下,RO3-与R-发生如下反应:RO3-+R-+H+-R2+H2O下列说法正确的是( ) A.该离子方程式配平后,H+的化学计量数为6 B.该反应中,被氧化的R元素与被还原的R元素的质量之比为1︰1 C.RO3-中的R只能被还原 D.R2在常温常压下一定是气体 7.下列叙述正确的是( ) A.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl- B.在反应4HCl(浓)+MnO2===MnCl2+Cl2↑+2H2O中,氧化剂与还原剂物质的量之比为1∶4 C.KMnO4、O2、H2O2、H2SO4(稀)、H2O、K2SO4、MnSO4存在于同一化学反应中,配平后硫酸的化学计量数为5 D.3Fe3O4+28HNO3===9Fe(NO3)3+NO↑+14H2O反应中每还原0.2 mol氧化剂,就有0.6 mol电子转移 8.常温下,在溶液中可发生以下反应:①16H++10Z-+2XO===2X2++5Z2+8H2O; ②2M2++R2===2M3++2R-; ③2R-+Z2===R2+2Z-。 由此判断下列说法错误的是( ) A.氧化性强弱顺序为:XO<Z2<R2<M3+ B.还原性强弱顺序为:X2+<Z-<R-<M2+ C.Z元素在反应①中被氧化,在③中被还原 D.常温下可发生反应2M2++Z2===2M3++2Z- 9.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应: 3NF3+5 H2O A.NF3是氧化剂,H2O是还原剂 B.HF是还原产物 C.还原剂和氧化剂的物质的量之比是2∶1 D.NF3在潮湿的空气中泄漏会产生红棕色气体 10.Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法可用化学方程式表示为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4↑+O2↑,对此反应说法不正确的是( ) A.Na2O2在反应中只作氧化剂 B.O2是氧化产物 C.Na2FeO4既是氧化产物又是还原产物 D.2 mol FeSO4发生反应时,共有10 mol电子转移 11.工业上制备二氧化氯(ClO2)的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应的化学方程式为:CH3OH+NaClO3+H2SO4→ClO2↑+CO2↑+Na2SO4+H2O(未配平),则下列说法正确的是( ) A.甲醇是氧化剂 B.通过反应可判断NaClO3的氧化性强于Na2SO4 C.还原产物和氧化产物的物质的量之比为6∶1 D.生成1 mol CO2时转移电子的物质的量为4 mol 12. NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程式是:MnO4-+NO2-+口→Mn2++NO3-+H2O。下列叙述中正确的是 ( ) A.该反应中NO2-被还原 B.反应过程中溶液的pH减小 C.生成1mol NaNO3需消耗0.4mol KMnO4 D.口中的粒子是OH- 13.(08上海卷)已知在热的碱性溶液中,NaClO发生如下反应:3NaClO A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4 14.在11.2 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成21.4 g沉淀,则下列表示X组成的选项中合理的是( ) A.0.3 mol NO2 B.0.3 mol NO、0.1 mol NO2 C.0.6 mol NO D.0.3 mol NO2、0.1 mol NO 15.24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度为0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( ) A.+2 B.+3 C.+4 D.+5 16.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: NO+4H++3e-===NO↑+2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。 ⑴写出并配平该氧化还原反应的化学方程式__________________________________________。 ⑵反应中硝酸体现了________、________的性质。 ⑶反应中若产生0.2 mol气体,则转移电子的物质的量为________mol。 ⑷若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________。 17.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空: ⑴写出并配平CCl4层由紫色变成无色的化学反应方程式: ⑵整个过程中的还原剂是 。 ⑶把KI换成KBr,则CCl4层变为 色:继续滴加氯水,CCl4层的颜色没有变化。 Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。 ⑷加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。 18.雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成填空: ⑴As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。 ⑵上述反应中的氧化剂是 ,反应产生的气体可用 吸收。 ⑶As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3-=2H3AsO4+ 3S+10NO2↑+ 2H2O 若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填"正极"或"负极")附近逸出。 ⑷若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。 a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定 19.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。 ⑴已知KBrO3在反应中得到电子,则该反应的还原剂是 。 ⑵已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。 ⑶根据上述反应可推知 。 a.氧化性:KBrO3 >H3AsO4 b.氧化性: H3AsO4> KBrO3 c.还原性:AsH3>X d.还原性: X> AsH3 20.在一定条件下,NO与NH3可以发生反应生成N2和H2O ,现在NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。 ⑴写出反应的化学方程式,并标明电子转移的方向和数目。 ⑵若以上反应完全进行,试计算原混合物中NO与NH3的物质的量可能各是多少? (责任编辑:admin) |
