|
第一章 从实验学化学 测试(第Ⅱ部分) 三、填空题: 1.质量比为16:7:6的三种气体 SO2、CO 、NO,分子个数之比为 ;氧原子个数之比为 ;相同条件下体积比为 。 2.有A、B、C、D、E五种化合物,它们分别由Na+、Ba2+、Cu2+、A13+、Cl—、S042—和0H—等七种离子中的两种组成。 ①白色固体A既不溶于水,也不溶于稀硝酸。 ②白色固体B不溶于水,但加入焰色反应为黄色(钠盐)的E溶液时,B溶解且生成无色溶液。 ③C与E具有相同的阴离子,C与稀硫酸反应可以生成A。 ④D与A阴阳离子均不相同,D溶液与E溶液反应可以得到蓝色沉淀。 根据上述实验事实,回答下列问题: ⑴写出下列物质的化学式:A_______ ____ B__________ C____________ D___________ E______ _____ ⑵写出C与稀硫酸反应的离子方程式:_____________________________ 3.在无土栽培中,配制1 L内含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为: ____________ 、 ________ 、 。 4.质量为73 g的HCl ⑴物质的量为_; ⑵约含有_个HCl; ⑶在标准状况下所占有的体积约为__L; ⑷将其溶于水配成1 000 mL溶液,则所得溶液的物质的量浓度为__ mol/L,若将上述溶液与1000 mL0.250 mol·L-1AlCl3溶液混合,所得溶液的Cl-的物质的量浓度为_______________,若再将混合溶液加水稀释到5L,则此时Cl-的物质的量浓度为_______________。 ⑸若这些HCl均为H2与Cl2化合而成,那么需Cl2__ mol,在标准状况下所占有的体积__L,若这些氯气是由MnO2与浓HCl反应制得的,则参加反应的HCl的质量是________。 四、实验题 1.已除去泥沙的粗盐中,仍含有Mg2+、Ca2+和SO42-,请填写下列空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。 实验目的:粗盐提纯,得到纯净氯化钠晶体 实验用品:(1)药品:粗盐.NaOH溶液.HCl溶液.Na2CO3溶液.BaCl2溶液, pH试纸,蒸馏水(2)仪器(略)
实验问题讨论 ⑴甲同学在多次过滤后,发现烧杯中的滤液仍浑浊。分析他操作不当的原因可能是: ① __________________________ ; ② 。 ⑵乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体,溶于水,滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是 。 ⑶实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯②固定铁圈的位置③放上蒸发皿④加热搅拌⑤停止加热、余热蒸干。其正确的操作顺序是 ( ) A.①②③④ B.①②③④⑤ C.②③①④⑤ D.②①③④⑤ 2.⑴阅读、分析下列两个材料:
 根据上述材料及课本知识,回答下列问题(填写序号): A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法 ⑴将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用__________。 ⑵将乙二醇和丙三醇相互分离的最佳方法是__________。 ⑶用CCl4提取溴水中的溴单质的最佳方法是_________. ⑷分离汽油和水的最佳方法是___________ 3.实验室制欲用固体NaOH来配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑴配制时,必须使用的仪器有____________(填代号),还缺少的仪器是 。 ⑵实验两次用到玻璃棒,其作用分别是:______________、______________。 ⑶配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_______________ 。 (4)在配制过程中,若其它操作均正确,下列操作会引起结果偏高的是 A.没有洗涤烧杯和玻璃棒 B.未等NaOH溶液冷却至室温就转移到容量瓶中 C.容量瓶不干燥,含有少量蒸馏水 D.定容时俯视标线 E.称量时间过长 ⑸用配制好的溶液,再来配制50 mL 0.2 mol/L的NaOH溶液,需要取原配好的溶液____ mL. 4.(选做)某中学高一化学兴趣小组的同学,在实验室探究用过量的锌与浓硫酸反应制取SO2。 ①这样制取的SO2中可能含有的杂质有 。 ②某同学用下列装置连接成一整套实验装置以验证①的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是 → → → → →(用a、b……填写;每套装置只允许使用一次)。 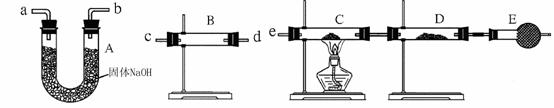 ③ 根据②确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论填入下表:
五、计算题 1.已知一定物质的量浓度的稀硫酸溶液100 mL与足量的锌粉充分反应,生成4.48L氢气(标准状况下)。求 ⑴有多少克锌参加反应; ⑵该稀硫酸的物质的量浓度; ⑶参加反应的锌失去电子的物质的量。 2.向50 mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到4.66g,并有气体产生。 ⑴写出有关离子方程式 ⑵原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是多少? ⑶产生的气体在标准状况下的体积是多少升? (责任编辑:admin) |
