|
寒假并不是休息的时候,而是二轮复习的开始。这个阶段,已经有了一轮复习知识点的积累,重点就要放在提升。小编整理了2018高考化学二轮复习知识点专题,氧化还原反应特征如下: 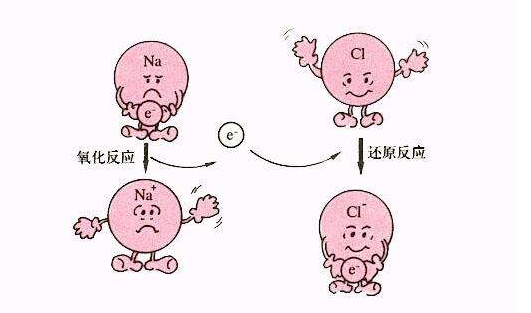 氧化还原反应: 第一次接触氧化还原反应应该是在初中学习高炉炼铁时: Fe2O3+ CO = Fe + CO2 在描述这个反应的时候,我们会说“CO将Fe-2O3还原成了Fe”。而对于S与O2反应时,我们会说O2把S氧化成了SO2。此时,我们认为是氧气把硫单质给氧化了。此时,我们认为“O2可以将其他物质氧化,而H2、CO可以将氧化物还原”。 到了高中,由于之前对于氧化还原的定义受限于氧元素,对于不含氧元素的物质不适用。所以我们对这个概念进行了扩展。 氧化还原反应的特征:反应前后元素的化合价具有相应变化的反应称作氧化还原反应。注:这是判断反应是否为氧化还原反应的判据。 氧化还原反应的实质:对于化合价的变化我们理解为是电子的转移。所以氧化还原反应的实质就是电子的转移。。 相关概念: 以高炉炼铁反应为例  氧化剂:反应物中,化合价降低的物质称作氧化剂。 还原剂:反应物中,化合价升高的物质称作还原剂。 氧化产物:生成物中,化合价升高的物质称作氧化产物。 还原产物:生成物中,化合价降低的物质称作还原产物。 注1:同一反应中可能出现两种或以上氧化剂(还原剂、氧化产物、还原产物)。  注2:同一物质可以既是氧化剂又是还原剂,也可以既是氧化产物又是还原产物。  注3: 氧化剂得到电子、化合价降低、变成还原产物; 还原剂失去电子、化合价升高、变成氧化产物。 电子转移的表示方法: 双线桥 箭头由氧化剂指向还原产物、还原剂指向氧化产物。标清得失电子以及电子数目。 单线桥 箭头由还原剂指向氧化剂,标清电子数目。 氧化还原反应的应用 反应顺序 多种氧化剂和多种还原剂同时存在时,最先发生发应的是氧化性和还原性最强的物质 特殊的氧化还原反应 归中反应:氧化产物和还原产物为同一物质  歧化反应:氧化剂和还原剂为同一物质 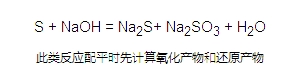 氧化性、还原性强弱的判断 在一个方程式中,氧化性强弱顺序为:氧化剂>氧化产物>还原产物>还原剂 还原性强弱顺序为:还原剂>还原产物>氧化产物>氧化剂 氧化还原反应相关计算 参与反应的物质 转移电子数 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |
