|
高三化学一轮复习建议高中化学碱金属知识点规律大全。如何正确把握高三化学一轮复习?只有记牢基础知识点,才能在以后的提升复习中快速提升。今天高中化学家教老师整理出高三化学一轮复习,碱金属知识点总结如下,希望帮助高三生理顺知识点。 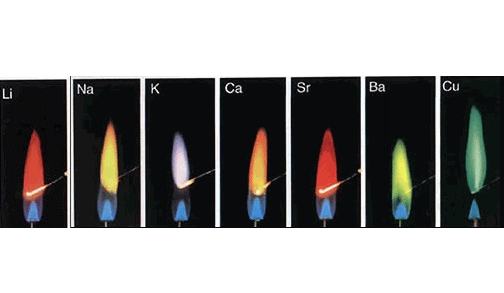 1.碱金属元素 碱金属包含锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素.由于钫是人工放射性元素,中学化学不作介绍. 2.碱金属元素的原子结构 相似性:碱金属元素的原子最外层都只有1个电子,次外层为8个电子(其中Li原子次外层只有2个电子).所以在化学反应中,碱金属元素的原子总是失去最外层的1个电子而显+1价. 递变性:Li、Na、K、Rb、Cs等碱金属元素的原子核外电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的吸引力逐渐减弱,失电子能力逐渐增强,元素的金属性逐渐增强. 3.碱金属的物理性质及其变化规律 (1)颜色:银白色金属(Cs略带金色光泽). (2)硬度:小,且随Li、Na、K、Rb、Cs,金属的硬度逐渐减小.这是由于原子的电子层数逐渐增多,原子半径逐渐增大,原子之间的作用力逐渐减弱所致.碱金属的硬度小,用小刀可切割. (3)碱金属的熔点低.熔点最高的锂为180.5℃,铯的熔点是28.4℃.随着原子序数的增加,单质的熔点逐渐降低. (4)碱金属的密度小.Li、Na、K的密度小于水的密度,且锂的密度小于煤油的密度.随着原子序数的增大,碱金属的密度逐渐增大.但钾的密度小于钠的密度,出现“反常”现象.这是由于金属的密度取决于两个方面的作用,一方面是原子质量,另一方面是原子体积,从钠到钾,原子质量增大所起的作用小于原子体积增大的作用,所以钾的密度反而比钠的密度小. 4.碱金属的化学性质 碱金属与钠一样都是活泼的金属,其性质与钠的性质相似.但由于碱金属原子结构的递变性,其金属活泼性有所差异,化合物的性质也有差异. (1)与水反应 相似性:碱金属单质都能与水反应,生成碱和氢气. 2R+2H2O=2ROH+H2↑(R代表碱金属原子) 递变性:随着原子序数的增大,金属与水反应的剧烈程度增大,生成物的碱性增强. 例如:钠与冷水反应放出热量将钠熔化成小球,而钾与冷水反应时,钾球发红,氢气燃烧,并有轻微爆炸.LiOH是中强碱,CsOH是最强碱. (2)与非金属反应 相似性:碱金属的单质可与大多数非金属单质反应,生成物都是含R+阳离子的离子化合物. 递变性:碱金属与氧气反应时,除锂和常温下缓慢氧化的钠能生成正常的氧化物(R2O)外,其余的碱金属氧化物是复杂氧化物. 4Li+O2=2Li2O 4Na+O2 2Na+O2Na2O2(过氧化钠,氧元素化合价-1) K+O2KO2(超氧化钾) (3)与盐溶液反应 碱金属与盐的水溶液反应时,首先是碱金属与水反应生成碱和氢气,生成的碱可能再与盐反应. 特别注意:碱金属单质都不能从盐溶液中置换出较不活泼金属.如: 2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑ 5.焰色反应 (1)概念:焰色反应是指某些金属或金属化合物在火焰上灼烧时,火焰呈现特殊的颜色(称焰色). (2)几种金属及其离子的焰色 Li(Li+)紫红Na(Na+)黄色 K(K+)紫色(透过蓝色钴玻璃观察) Cu(Cu2+)绿色Ca(Ca2+)砖红色 Ba(Ba2+)黄绿色Sr(Sr2+)洋红色 (3)焰色反应是物理变化.焰色是因为金属原子或离子外围电子发生跃迁,然后回落到原位时放出的能量.由于电子回落过程放出能量的频率不同而产生不同的光.所以焰色反应属于物理变化(但单质进行焰色反应时,由于金属活泼则易生成氧化物,此时既有物理变化又有化学变化). (4)焰色反应实验的注意事项 a.火焰最好是无色的或浅色的,以免干扰观察离子的焰色. b.每次实验前要将铂丝在盐酸中洗净并在灯焰上灼烧至火焰无色(在酒精灯焰上烧至不改变焰色)。 c.观察K+的焰色应透过蓝色钴玻璃片,以滤去对紫色光有遮盖作用的黄光,避免杂质Na+所造成的干扰. 6.碱金属的实验室保存方法 碱金属都是活泼金属,极易与空气中的水、氧气等反应,保存时应隔绝空气和水.金属钠、钾、铷、铯保存在干燥的煤油或液体石蜡中,而金属锂的密度比煤油的密度小,只能保存于液体石蜡中. 7.碱金属元素单质及化合物的特性 (1)一般而言,在金属活动性顺序中前面的金属能把后面的金属从其盐溶液中置换出来.但这一结论不适宜于活泼金属(K、Ca、Na等). 如将金属K投入饱和NaCl溶液中,则不会发生反应: K+NaCl=KCl+Na(该反应在溶液中不能发生) 此时,由于2K+2H2O=2KOH+H2↑,H2O减少,如果温度不变,会有NaCl晶体析出. (2)一般合金为固态,而Na—K合金在常温时为液态. (3)一般酸式盐的溶解度大于正盐,而NaHCO3的溶解度小于Na2CO3. (4)钾的化合物可作肥料,但钾的氧化物和KOH除外. (5)碱金属元素随原子序数的增大,其单质的密度一般也增大,但钾的密度却反常,Na为0.97g/cm3,而K为0.86g/cm3. (6)由于碱金属都很活泼,在常温下就容易跟空气中的O2、水等反应,所以碱金属单质通常保存在煤油中.但锂的密度为0.534g/cm3,比煤油的密度(0.8g/cm3)小,所以不能把锂保存在煤油中,常把锂封存在固体石蜡中. 相关您感兴趣的高三化学一轮备考复习内容推荐: 高三化学一轮复习笔记,常考的化学实验现象80条 高三化学第一轮复习笔记整理,高中化学卤族元素知识点 高三化学一轮复习策略,高三化学物质结构与性质 高三化学一轮复习建议,高中化学反应及其能量知识点 高三化学一轮复习建议高中化学碱金属知识点规律大全 高三化学一轮复习,物质的量(含溶解度)知识点总结 (责任编辑:admin) |
