|
一、研究物质性质的方法和程序 化学的学习始终围绕着化学物品的性质、化合价及化学方程式,想要学好化学就得学好化学方程式。但是化学方程式的书写又涉及了方方面面,如配平、化学式的书写等。为了方便大家学习化学,高中学习网www.gaozhong.cc小编为大家整理了高一的化学方程式汇总,希望帮助大家学好高中化学。 一、相关离子方程式及各方程式 1、硫酸根离子的检验:BaCl2+Na2SO4=BaSO4↓+2NaCl 2、碳酸根离子的检验:CaCl2+Na2CO3=CaCO3↓+2NaCl 3、碳酸钠与盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑ 4、木炭还原氧化铜:2CuO+C高温2Cu+CO2↑ 5、铁片与硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu 6、氯化钙与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl 7、钠在空气中燃烧:2Na+O2△Na2O2 钠与氧气反应:4Na+O2=2Na2O 8、过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2 10、钠与水反应:2Na+2H2O=2NaOH+H2↑ 11、铁与水蒸气反应:3Fe+4H2O(g)=F3O4+4H2↑ 12、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 13、氧化钙与水反应:CaO+H2O=Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O 15、氧化铝与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2=4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3△Fe2O3+3H2O↑ 21、实验室制取氢氧化铝:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH=NaAlO2+2H2O 24、氢氧化铝加热分解:2Al(OH)3△Al2O3+3H2O 25、三氯化铁溶液与铁粉反应:2FeCl3+Fe=3FeCl2 26、氯化亚铁中通入氯气:2FeCl2+Cl2=2FeCl3  二、碱金属 1.新切的钠有银白色光泽,但很快发暗;方程式:4Na+O2=2Na2O;该产物不稳定。钠在空气中燃烧时,发出黄色的火焰;同时生成淡黄色的固体,方程式:2Na+O2点燃====Na2O2。锂燃烧方程式:4Li+O2点燃====2Li2O;钾燃烧方程式:K+O2点燃====KO2。 2.钠与氧气在不点火时平稳反应,硫的化学性质不如氧气活泼,将钠粒与硫粉混合时爆炸,方程式:2Na+S=Na2S 3.钠与水剧烈反应后滴有酚酞的水变成红色,方程式:2Na+2H2O=2NaOH+H2↑;钾与水反应更剧烈,甚至爆炸,为了安全,常在小烧杯上盖一块小玻璃片。 4.过氧化钠粉末用脱脂棉包住,①滴几滴水,脱脂棉燃烧;方程式:2Na2O2+2H2O=4NaOH+O2↑;②用玻璃管吹气,脱脂棉也燃烧;有关的方程式:2Na2O2+2CO2=2Na2CO3+O2↑;这两个反应都是放热反应,使脱脂棉达到着火点。在过氧化钠与水或CO2反应生成O2的两个反应中,为生成1molO2,需要的Na2O2的物质的量都为2mol,同时需要的H2O或CO2的物质的量都为2mol。 5.纯碱的化学式是Na2CO3,它不带结晶水,又俗名苏打。碳酸钠晶体化学式是Na2CO3?10H2O,在空气中不稳定,容易失去结晶水,风化,最后的产物是粉末状,叫无水碳酸钠。钠、氧化钠、过氧化钠、氢氧化钠等在空气中露置的最后产物都是无水碳酸钠。 6.碳酸钠和碳酸氢钠两种固体物质都可以与盐酸反应放出气体,有关离子方程式分别为:CO32-+2H+=H2O+CO2↑;HCO3-+H+=H2O+CO2↑;其中,以碳酸氢钠与盐酸的反应速度更快;如果碳酸钠和碳酸氢钠的质量相同,当它们完全反应时消耗的盐酸以碳酸钠为多。 7.碳酸钠和碳酸氢钠的热稳定性较差的是碳酸氢钠,其加热时发生分解,方程式是:2NaHCO3=Na2CO3+H2O+CO2↑。在这个分解反应中,每42gNaHCO3发生分解就生成标准状况下CO2气体5.6L。在这个分解反应中,一种物质生成了三种物质, (1)高锰酸钾分解: 2KMnO4△====K2MnO4+MnO2+O2↑ (2)碳酸铵或碳酸氢铵分解: (NH4)2CO3△====2NH3↑+H2O+CO2↑ 8.除去碳酸钠固体中的少量NaHCO3的方法是加热;除去碳酸氢钠溶液中混有的少量Na2CO3溶液的方法是: 通入足量CO2气体:Na2CO3+CO2+H2O=2NaHCO3。 9.从NaOH溶液得到纯净的Na2CO3溶液的方法是把NaOH溶液分为二等份,一份通入足量CO2使之全部成为NaHCO3;然后把另份NaOH溶液加入到此溶液中,摇匀即可。两个方程式分别为:NaOH+CO2=NaHCO3; NaHCO3+NaOH=Na2CO3+H2O 10.往稀的碳酸钠溶液中加入几滴稀盐酸,离子方程式为H++CO32-=HCO3-。 11.碳酸钠和碳酸氢钠分别滴入澄清石灰水中,反应的离子方程式分别为: CO32-+Ca2+=CaCO3↓; HCO3-+Ca2++OH-=CaCO3↓+H2O。 两溶液中只有Na2CO3可以使CaCl2溶液出现白色沉淀,离子方程式为:CO32-+Ca2+=CaCO3↓。 三、制备气体的化学方程式 1、制氧气: 2KClO3(MnO2,加热)=2KCl+3O2↑ 2KMnO4加热=K2MnO4+MnO2+O2↑ 2、制氢气: Zn+2HCl=ZnCl+H2↑ Zn+H2SO4=ZNSO4+H2↑ 3、制二氧化碳: CaCO3+2HCl=CaCl2+CO2↑(不能用H2SO4) 4、HCl: 2NaCl+H2SO4(浓)=(加热)=Na2SO4+2HCl↑ 5、制氨 2NH4Cl+Ca(OH)2=加热=2NH3↑+CaCl2+2H2O 6、一氧化碳: H2SO4+HCOOH=加热=H2O+CO↑ 7、制一氧化氮 3Cu+8HNO3(稀)=加热=3Cu(NO3)2+2NO↑+4H2O 8、制二氧化氮 Cu+4HNO3(浓)=加热=Cu(NO3)2+2NO2↑+2H2O 9、制二氧化硫 Na2SO3+H2SO4(浓)==Na2SO4+H2O+SO2↑ 10、制三氧化硫 P2O5+3H2SO4(浓)=加热=2H3PO4+3SO3↑ 11、制硫化氢 FeS+2HCl(稀)==FeCl2+H2S↑ Na2S+H2SO4=Na2SO4+H2S↑ 12、制甲烷 CHCl3+3Zn+3H20→CH4↑+3Zn(OH)Cl 13、其他 NaBr+H3PO4(浓)===NaH2PO4+HB↑ NaI+H3PO4===NaH2PO4+HI↑ CaF2+H2SO4(浓)====CaSO4+2HF↑ 希望小编上面总结的内容对大家的学习能够有所帮助。 篇二 : 人教版高一化学方程式大全 高一化学方程式总结(一)/// 1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 △ Na2O2 钠与氧气反应:4Na + O2 = 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O = Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 高一化学方程式大全 人教版高一化学方程式大全 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O↑ 21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 24、氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2O 25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2 26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 27、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑ 28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3 29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O 30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ 31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ 32、氯气与金属铁反应:2Fe + 3Cl2 点燃 2FeCl3 33、氯气与金属铜反应:Cu + Cl2 点燃 CuCl2 高一化学方程式大全 人教版高一化学方程式大全 34、氯气与金属钠反应:2Na + Cl2 点燃 2NaCl 35、氯气与水反应:Cl2 + H2O = HCl + HClO 36、次氯酸光照分解:2HClO 光照 2HCl + O2↑ 37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O 38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3 40、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO 41、二氧化硫与水反应:SO2 + H2O ≒ H2SO3 42、氮气与氧气在放电下反应:N2 + O2 放电 2NO 43、一氧化氮与氧气反应:2NO + O2 = 2NO2 44、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO 45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂 2SO3 46、三氧化硫与水反应:SO3 + H2O = H2SO4 47、浓硫酸与铜反应:Cu + 2H2SO4(浓) △ CuSO4 + 2H2O + SO2↑ 48、浓硫酸与木炭反应:C + 2H2SO4(浓) △ CO2 ↑+ 2SO2↑ + 2H2O 49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑ 50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑ 51、氨水受热分解:NH3·H2O △ NH3↑ + H2O 52、氨气与氯化氢反应:NH3 + HCl = NH4Cl 高一化学方程式大全 人教版高一化学方程式大全 53、氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑ 54、碳酸氢氨受热分解:NH4HCO3 △ NH3↑ + H2O↑ + CO2↑ 55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O 56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △ CaCl2 + 2H2O + 2NH3↑ 57、氯气与氢气反应:Cl2 + H2 点燃 2HCl 58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O 59、SO2 + CaO = CaSO3 60、SO2 + 2NaOH = Na2SO3 + H2O 61、SO2 + Ca(OH)2 = CaSO3↓ + H2O 62、SO2 + Cl2 + 2H2O = 2HCl + H2SO4 63、SO2 + 2H2S = 3S + 2H2O 64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O 65、Si + 2F 2 = SiF4 66、Si + 2NaOH + H2O = Na2SiO3 +2H2↑ 67、硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英沙)(焦碳) (粗硅) 粗硅转变为纯硅:Si(粗) + 2Cl2 △ SiCl4 SiCl4 + 2H2 高温 Si(纯)+ 4HCl 篇三 : 高一化学方程式最全 高中化学必修一、必修二相关化学方程式 高一上学期:必修1 高一下学期:必修2 文科倾向:高二 选学选修一、选修六; 理科倾向:高二上学期:必学<选修四> 高二下学期:《选修三》和《选修五》都学 可能会学选修二 高中化学必修一、必修二相关化学方程式 【作者】白老师 【日期】2014-6-11 1、硫酸根离子的检验: BaCl2 + Na2SO4 ==== BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl 3、碳酸钠与盐酸反应: Na2  CO3 + 2HCl ===== 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 Na2O2 钠与氧气反应:4Na + O2 ==== 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al+ 2NaOH + 2H2O == 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O ==== Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O 16 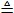 、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH ===== Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠反应:FeSO4 + 2NaOH ==== Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 == 4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 + 3H2O↑ 21、实验室制氢氧化铝:Al2(SO4  )3 + 6NH3·H2O == 2Al(OH)3↓ + 3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl ==== AlCl3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH ==== NaAlO2 + 2H2O 24、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O 1 高中化学必修一、必修二相关化学方程式 25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe ==== 3FeCl2 26、氯化亚铁中通入氯气:2FeCl2 + Cl2 ===== 2FeCl3 27、二氧化硅与氢氟酸反应:SiO2 + 4HF ==== SiF4 + 2H2O 硅单质与氢氟酸反应:Si + 4HF ==== SiF4 + 2H2↑ 28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3 29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH ==== Na2SiO3 + H2O 30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2+H2O== Na2CO3 + H2SiO3↓ 31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓ 32、氯气与金属铁反应:2Fe + 3Cl2 33、氯气与金属铜反应:Cu + Cl2 点燃 2FeCl3 点燃 CuCl2 2NaCl 34、氯气与金属钠反应:2Na + Cl2 点燃 35、氯气与水反应:Cl2 + H2O ==== HCl + HClO 36、次氯酸光照分解:2HClO 光照 2HCl + O2↑ 37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH ===== NaCl + NaClO + H2O 38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 ==== CaCl2 + Ca(ClO)2 + 2H2O 39、盐酸与硝酸银溶液反应:HCl + AgNO3 ==== AgCl↓ + HNO3 40、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 ==== CaCO3↓ + 2HClO 41、二氧化硫与水反应:SO2 + H2O === H2SO3 42、氮气与氧气在放电下反应:N2 + O2 放电 2NO 43、一氧化氮与氧气反应:2NO + O2 ==== 2NO2 44、二氧化氮与水反应:3NO2 + H2O ==== 2HNO3 + NO 45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 46、三氧化硫与水反应:SO3 + H2O ==== H2SO4 47、浓硫酸与铜反应:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑ 催化剂 2SO3 48、浓硫酸与木炭反应:C + 2H2SO4(浓) CO2 ↑+ 2SO2↑ + 2H2O 49、浓硝酸与铜反应:Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2H2O + 2NO2↑ 50、稀硝酸与铜反应:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 4H2O + 2NO↑ 2 高中化学必修一、必修二相关化学方程式 51、氨水受热分解:NH3·H2O NH3↑ + H2O 52、氨气与氯化氢反应:NH3 + HCl ==== NH4Cl 53、氯化铵受热分解:NH4Cl NH3↑ + HCl↑ 54、碳酸氢氨受热分解:NH4HCO NH=↑ + H2O↑ + CO2↑ 55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH NH3↑ + NaNO3 + H2O 56、氨气的实验室制取:2NH4Cl + Ca(OH)2  CaCl2 + 2H2O + 2NH3↑ 57、氯气与氢气反应:Cl2 + H2 点燃 2HCl 58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH 2NH3↑ + Na2SO4 + 2H2O 59、SO2 + CaO ==== CaSO3 60、SO2 + 2NaOH ==== Na2SO= + H2O 61、SO2 + Ca(OH)= ==== CaSO3↓ + H2O 62、SO2 + Cl2 + 2H2O ==== 2HCl + H2SO4 63、SO2 + 2H2S ==== 3S + 2H2O 64、NO、NO2的回收:NO2 + NO + 2NaOH ==== 2NaNO2 + H2O 65、Si + 2F2 === SiF4 66、Si + 2NaOH + H2O ==== Na2SiO3 +2H2↑ 67、硅单质的实验室制法 粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英沙) (焦碳) (粗硅) 粗硅转变为纯硅:Si(粗) + 2Cl2 错误!未找到引用源。 SiCl4 SiCl4 + 2H2 高温 Si(纯)+ 4HCl 必修二 第一章 物质结构 元素周期律 1、Li与O2反应(点燃): 4Li + O2 错误!未找到引用源。2Li2 O Na与O2反应(点燃): 2Na+O2 Na2O2 3 高中化学必修一、必修二相关化学方程式 Na与H2O反应: 2Na+2H2O===2NaOH+H2↑ K与H2O反应: 2K+2H2O===2KOH+H2↑ 2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应: F2 + H2 === 2HF Cl2 + H2 错误!未找到引用源。= 2HCl Br2 + H2 错误!未找到引用源。= 2Br I2 + H2 错误!未找到引用源。= 2HI 3、卤素单质间的置换反应: (1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应: ① Cl2+2NaBr===Br2+2NaCl ② Cl2+2NaI===I2+2NaCl (2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr 4、Mg与H2O反应:Mg+2H2O 错误!未找到引用源。= Mg(OH)2+H2↑ Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑ Mg与HCl反应: Mg+2 HCl 错误!未找到引用源。= MgCl2+ H2↑ 5、Na与Cl2反应(点燃): 6用电子式表示氯化氢的形成过程: 第二章 化学反应与能量 1、Ba(OH)2?8H2O与NH4Cl的反应 : Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O 2、原电池原理 典型的原电池(Zn-Cu原电池) 负极(锌):Zn-2e-===Zn2+(氧化反应) 正极(铜):2H++2e-===H2↑(还原反应) 电子流动方向:由锌经过外电路流向铜。 总反应离子方程式:Zn+2H+===Zn2++H2↑ 3、H2O2在催化剂作用下受热分解: 2H2O2 错误!未找到引用源。2H2O+O2↑ 4、Na2SO4与CaCl2反应:Na2SO4+CaCl2===CaSO4↓+Na2CO3 5、高炉炼铁:2C + O2 === 2CO Fe2O3 + 3CO 错误!未找到引用源。2Fe + 3CO2 第三章 有机化合物 1、甲烷的主要化学性质 (1)氧化反应(与O2 的反应):CH4 (g)+2O2 (g) ?点燃??? CO2 (g)+2H2 O(l) (2)取代反应(与Cl2在光照条件下的反应,生成四种不同的取代物): 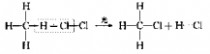  4 、 高中化学必修一、必修二相关化学方程式 2、乙烯的主要化学性质 ? 2CO2+2H2O (1)氧化反应(与O2的反应):C2H4+3O2 ??? (2)加成反应((与Br2的反应) 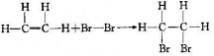 : 点燃 (3)乙烯还可以和氢气、氯化氢、水等发生加成反应: CH2=CH2 + H2CH2=CH2+HClCH2=CH2+H2O CH3CH3 CH3CH2Cl(一氯乙烷) CH3CH2OH(乙醇) (4)聚合反应: (乙烯制聚乙烯)① (氯乙烯制聚氯乙烯)② 3、苯的主要化学性质: ? 12CO2+6H2O (1)氧化反应(与O2的反应):2C6H6+15O2 ??? (2)取代反应: FeBr  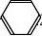  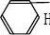 3 ??  ?? ① 与Br的反应 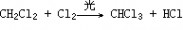     2 2 点燃 ② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气 味、密度大于水的油状液体——硝基苯。反应方程式: 2 (3 浓硫酸 △ NO2 2O ??用镍做催化剂,苯与氢发生加成反应:?? 4、乙醇的重要化学性质 (1)乙醇与金属钠的反应:2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ 催化剂 5 高中化学必修一、必修二相关化学方程式 (2)乙醇的氧化反应 ? 2CO2+3H2O ①乙醇的燃烧: CH3CH2OH+3O2 ??? Cu或Ag???? 2CHCHO+2HO ②乙醇的催化氧化反应: 2CHCHOH+O 32232点燃 ③乙醇在常温下的氧化反应: 酸性KMnO4或酸性重铬酸钾溶液??????????CHCOOH CHCHOH323 5、乙酸的重要化学性质 (1)乙酸的酸性 ①乙酸能使紫色石蕊试液变红 ②乙酸能与碳酸盐反应,生成二氧化碳气体 利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3): 2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑ 乙酸还可以与碳酸钠反应,也能生成二氧化碳气体: 2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑ 上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。 (2)乙酸的酯化反应  ①反应原理(与乙醇的反应): 乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。 6、①蔗糖水解反应:C12H22O11+H2O→C6H12O6+C6H12O6 ②淀粉(纤维素)水解反应: ③油脂的重要化学性质——水解反应: 酸??甘油+高级脂肪酸 a)油脂在酸性条件下的水解: 油脂+H2O? b)油脂在碱性条件下的水解(又叫皂化反应): ??甘油+高级脂肪酸 油脂+H2O? ?各种氨基酸 蛋白质+H2O??? 第四章 化学与可持续发展 6 酶等碱 高中化学必修一、必修二相关化学方程式 1、HgO受热分解:2HgO Ag2O受热分解:2Ag2O 2Hg + O2↑ 4Ag + O2↑ 2、CO还原Fe2O3:Fe2O3 + 3CO ① C 还原ZnO :2 ZnO + C ② C 还原MgO : MgO +C 高温高温 2Fe +3CO2 (高炉炼铁) 2 Zn +CO2↑ 高温 Mg + CO↑ ③ Al 还原Fe2O3(铝热反应): Fe2O3 + 2Al 高温 2Fe + Al2O3 ④ Fe还原CuSO4: CuSO4 + Fe ==== FeSO4 +Cu (湿法炼铜) 3、电解 ①电解NaCl:2NaCl(熔融) ②电解MgCl2: MgCl2(熔融) ③电解 4、石油的催化裂化 电解电解 2Na +Cl2↑ Mg +Cl2↑ 4Al + 3O2↑ 电 解Al2O3: 2Al2O3(熔融) 冰晶石 催化剂?????例如:C4H10 加热、加压 C2H4 + C2H6 催化剂????? C16H34 加热、加压 C8H18 +C8H16 催化剂????? C8H18 加热、加压 C4H10 +C4H8 催化剂?????CH+CH加热、加压 C4H10 4 36 催化剂?????CH+CH 加热、加压 C4H10 24 26 根据离子方程式的书写原则,将化学方程式转换为离子方程式,可以加深印象,更有利于你的记忆! (责任编辑:admin) |
