2018高考化学冲刺,酸碱中和滴定知识总结
http://www.newdu.com 2025/12/02 01:12:41 三好网 佚名 参加讨论
2018高考化学备考过程中,很多同学感到化学知识点多,记起来很吃力。但是,如果将一些知识点总结起来,形成脉络体系,综合记忆,就会容易很多。小编将2018高考化学冲刺,酸碱中和滴定知识总结如下:  1.实验原理 (1)用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定酸(或碱)的浓度。 (2)利用酸碱指示剂明显的颜色变化,表示反应已完全,指示滴定终点。 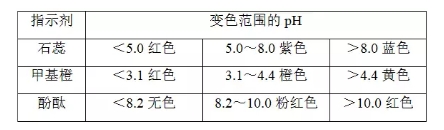 指示剂选择的基本原则 变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。 ①不能用石蕊作指示剂。 ②滴定终点为碱性时,用酚酞作指示剂,例如用NaOH溶液滴定醋酸。 ③滴定终点为酸性时,用甲基橙作指示剂,例如用盐酸滴定氨水。 ③强酸滴定强碱一般用甲基橙,但用酚酞也可以。 2.实验用品 (1)仪器:酸式滴定管(如图A)、碱式滴定管(如图B)、滴定管夹、铁架台、锥形瓶。 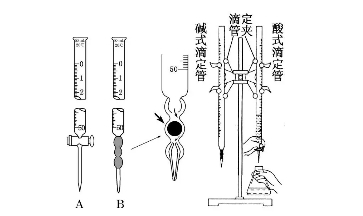 2)试剂:标准液、待测液、指示剂、蒸馏水。 (3)滴定管的使用  3.实验操作(以标准盐酸滴定待测NaOH溶液为例)  (3)终点判断 等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。 (4)操作步骤 ①仪器的洗涤 滴定管(或移液管):自来水→蒸馏水→待装溶液润洗。 锥形瓶:自来水→蒸馏水(禁止用所装溶液洗涤)。 ②装液调整液面 装液,使液面一般高于“0”刻度,驱除玻璃尖嘴处的气泡。 ③读数 调整液面在“0”刻度或“0”刻度以下,读出初读数,记为“X.XX mL”,滴定终点,读出末读数,记为“YY.YY mL”,实际消耗滴定剂的体积为(YY.YY-X.XX) mL。 4.数据处理 按上述操作重复二至三次,根据用去标准盐酸体积的平均值,求出c(NaOH)。 5.误差分析(以标准酸溶液滴定未知浓度的碱(酚酞作指示剂)为例) 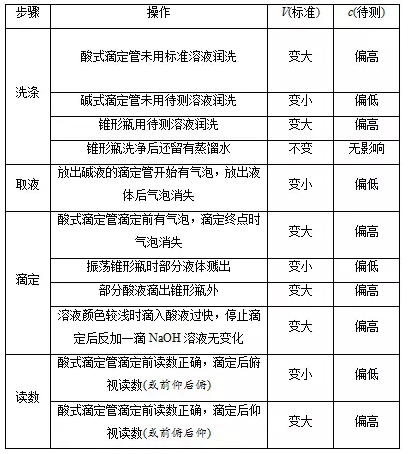 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |