2018高考化学冲刺,原电池原理知识总结
http://www.newdu.com 2025/12/02 06:12:02 三好网 佚名 参加讨论
2018高考化学备考过程中,很多同学感到化学知识点多,记起来很吃力。但是,如果将一些知识点总结起来,形成脉络体系,综合记忆,就会容易很多。小编将2018高考化学冲刺,原电池原理知识总结如下: 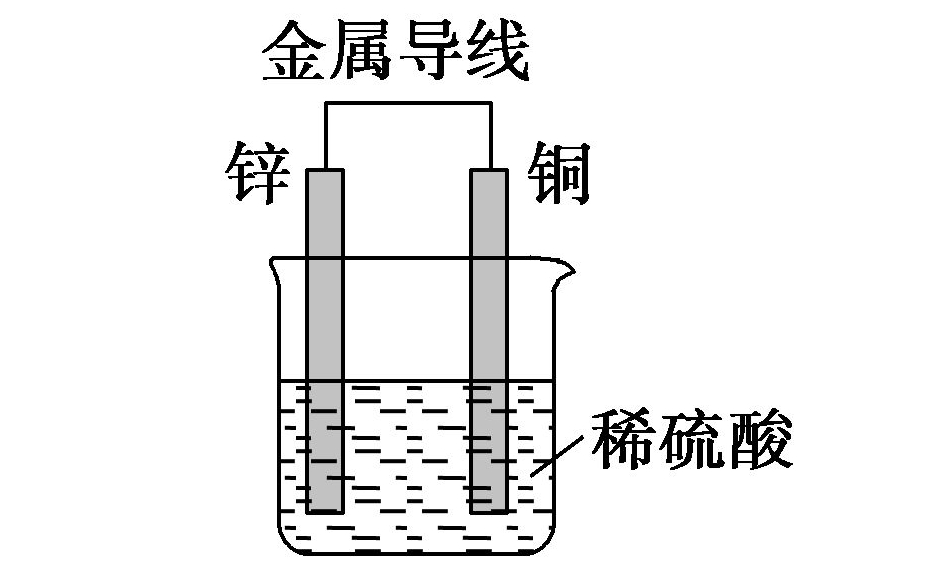 1.概念 利用氧化还原反应原理将化学能转化为电能的装置。 2.构成条件 (1)一般为两个活泼性不同的电极(常见为金属或石墨) (2)将电极插入电解质溶液中 (3)闭合回路 (4)有自发进行的氧化还原反应 3.工作原理 例如,Cu--Zn原电池。 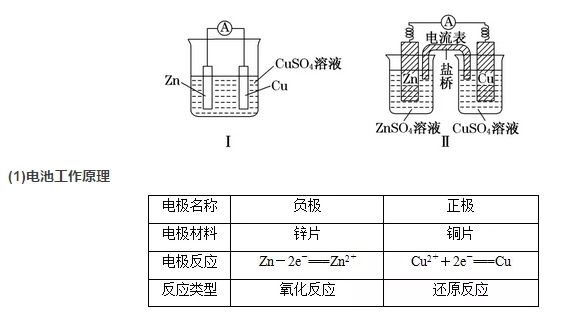 (2)原电池中的三个方向 ①电子方向:从负极流出沿导线流入正极。 ②电流方向:从正极沿导线流向负极。 ③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。 备注:离子迁移方向,结合溶液局部电中性理解。 (3)两种装置的比较 装置Ⅰ中还原剂Zn与氧化剂Cu2+直接接触,易造成能量损耗。 装置Ⅱ能避免能量损耗,盐桥一般是由琼脂和饱和氯化钾或饱和硝酸钾溶液构成,为了减小液接电位,转移离子而在两种溶液之间连接的高浓度电解质溶液。 4.原电池正、负极的判断方法 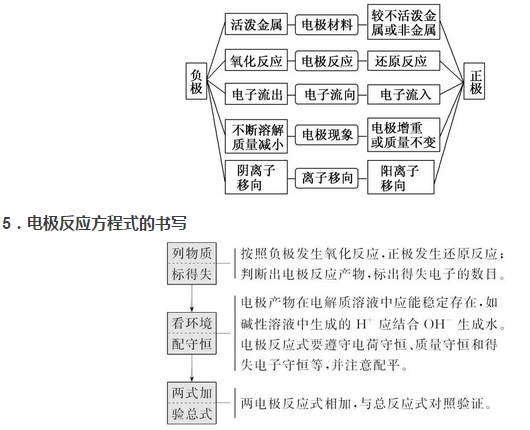 6.原电池原理的应用 (1)加快氧化还原反应的速率 (2)比较金属活动性强弱 (3)金属的防护---牺牲阳极的阴极保护法 (4)设计化学电池 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |