2018高考化学冲刺,溶液的酸碱性与pH知识总结
http://www.newdu.com 2025/12/02 08:12:42 三好网 佚名 参加讨论
2018高考化学备考过程中,很多同学感到化学知识点多,记起来很吃力。但是,如果将一些知识点总结起来,形成脉络体系,综合记忆,就会容易很多。小编将2018高考化学冲刺,溶液的酸碱性与pH知识总结如下:  1.溶液的酸碱性 溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。 酸性溶液中:c(H+)>c(OH-) 中性溶液中:c(H+)=c(OH-) 碱性溶液中:c(H+)<c(OH-) 2.混合溶液酸碱性的判断规律 (1)等浓度等体积一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性” 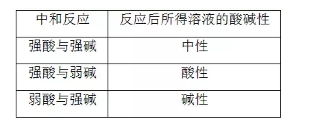 (2)室温下,已知酸和碱pH之和的溶液等体积混合 (1)两强混合 ①若pH之和等于14,则混合后溶液显中性,pH=7。 ②若pH之和大于14,则混合后溶液显碱性,pH>7。 ③若pH之和小于14,则混合后溶液显酸性,pH<7。 (3)一强一弱混合——“谁弱显谁性” pH之和等于14时,一元强酸和一元弱碱等体积混合呈碱性;一元弱酸和一元强碱等体积混合呈酸性。 3.溶液的pH  (3)pH试纸的适用范围:0~14 (4)pH试纸的使用 ①方法:把小片试纸放在表面皿上,用玻璃棒蘸取待测液点在干燥的pH试纸上,试纸变色后,与标准比色卡对比即可确定溶液的pH。 ②注意:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能会产生误差。广泛pH试纸只能测出整数值。 4.关于pH的计算 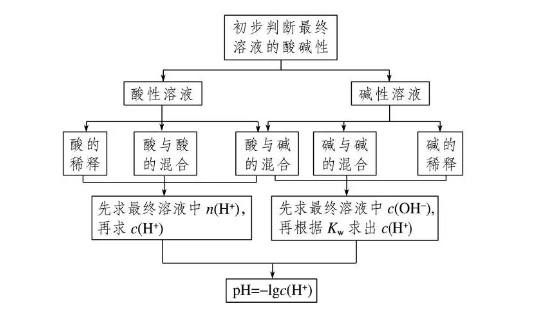 5.酸、碱稀释时两个误区 (1)不能正确理解酸、碱的无限稀释规律 常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。 (2)不能正确理解弱酸、弱碱的稀释规律 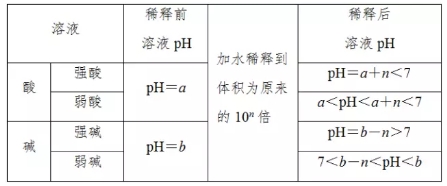 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |