2018高考有机化学二轮复习苯及其同系物知识点
http://www.newdu.com 2025/12/01 10:12:33 三好网 佚名 参加讨论
2018年高考二轮复习是高考成绩提升的关键期,考生一定要积极备考,梳理高中学科知识脉络,牢记知识点。小编整理了2018高考有机化学二轮复习知识点,苯及其同系物知识总结如下: 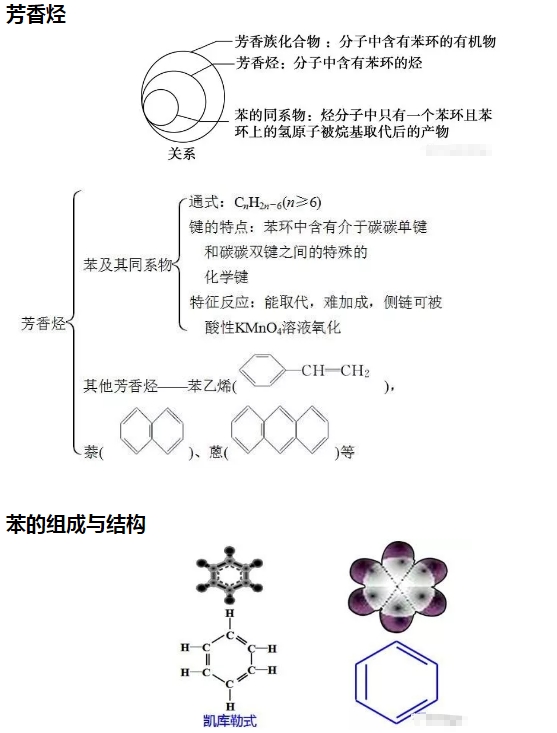 苯的结构特点 (1)苯分子为平面正六边形结构。 (2)分子中6个碳原子和6个氢原子共平面。 (3)6个碳碳键完全相同,是一种介于碳碳单键和碳碳双键之间的特殊化学键。 3.苯的化学性质 (1)苯不能被酸性KMnO4溶液氧化,但能燃烧。苯燃烧时,发出明亮而且带有浓烟的火焰,这是由于苯分子含碳量高,碳燃烧不充分。其燃烧的化学方程式为: 2C6H6+15O2→12CO2+6H2O (2)在有催化剂FeBr3存在时,苯与液溴发生反应,苯环上的氢原子被溴原子取代,生成溴苯。 (3)苯与浓硝酸和浓硫酸的混合物共热至50~60 ℃发生反应,苯环上的氢原子被硝基(—NO2)取代,生成硝基苯。 (4)苯虽然不具有像烯烃一样典型的碳碳双键,但在特定条件下,仍能发生加成反应,在镍作催化剂的条件下,苯可以与氢气发生加成反应。 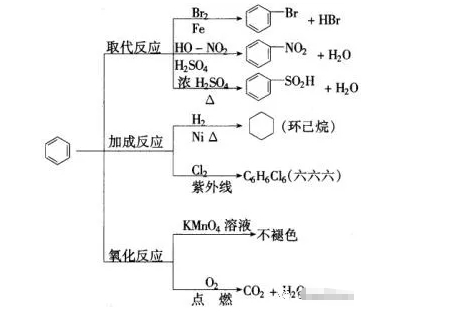 溴苯的制备实验 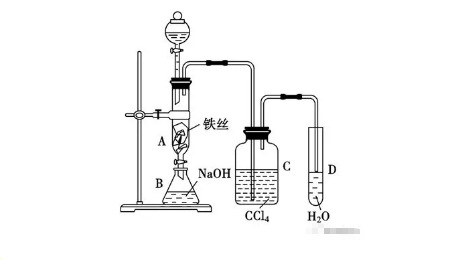 实验装置分析 ① 分液漏斗,可以通过控制液溴的量,控制反应的量; ② 用四氯化碳除溴蒸气; ③ 长导管可以使反应液冷凝回流; ④ 实验结束,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴。(Br2+2NaOH==NaBr+NaBrO+H2O) ⑤ 若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。 注意事项: ①用液溴,不能用溴水; ②不用加热; ③防倒吸; 苯的同系物 通式:CnH2n-6(n>6) 结构特点 ①分子中含有一个苯环 ②与苯环相连的是烷烃基 主要的化学性质 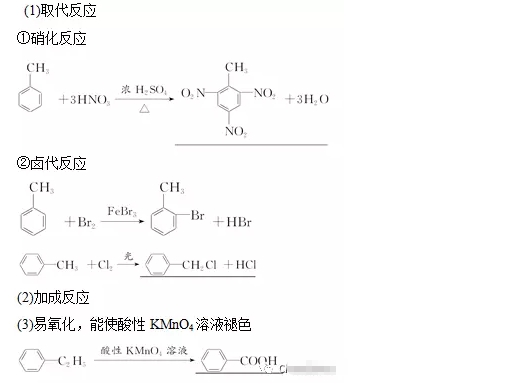 (1)怎样证明苯与溴发生的是取代反应而不是加成反应? 答案:生成了溴化氢分子。 (2)液溴与苯的反应催化剂为FeBr3,若实验中换加Fe粉,实验同样能够成功,为什么? 答案:因为Fe粉可与液溴反应生成FeBr3。 (3)苯与溴的取代产物溴苯为无色、不溶于水且比水重的油状液体,而实验中得到的溴苯因溶有溴而呈黄褐色,如何提纯得到无色的溴苯? 答案:将呈黄褐色的溴苯与NaOH溶液混合,充分振荡后静置,使液体分层,然后分液。 (4)用浓溴水、苯、铁粉三者混合反应直接制取溴苯,未能获得成功,为什么? 答案:应该用液溴代替浓溴水。 (5)苯的硝化反应中要用浓硫酸作催化剂和吸水剂,如何混合浓硫酸和浓硝酸? 答案:将浓H2SO4沿试管内壁慢慢注入浓硝酸中,并不断振荡。 (6)怎样控制反应温度为50~60℃? 答案:在50~60℃的水中水浴加热。 (7)苯的同系物被酸性KMnO4溶液氧化的规律是什么? 答案:(1)苯的同系物或芳香烃侧链为烃基时,不管烃基碳原子数为多少,只要直接与苯环相连的碳原子上有氢原子,均能被酸性KMnO4溶液氧化为羧基,且羧基直接与苯环相连。并不是所有苯的同系物都能使酸性KMnO4溶液褪色,如就不能,原因是与苯环直接相连的碳原子上没有氢原子。 (8)如何检验苯乙烯中含有甲苯? 答案:检验苯的同系物之前必须先排除碳碳双键的干扰。取适量样品于试管中,先加入足量Br2的CCl4溶液充分反应后,再滴加酸性高锰酸钾溶液振荡,若高锰酸钾溶液褪色,证明含有甲苯。 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |