2018高考化学冲刺,化学反应热计算知识总结
http://www.newdu.com 2025/12/02 01:12:40 三好网 佚名 参加讨论
2018高考化学备考过程中,很多同学感到化学知识点多,记起来很吃力。但是,如果将一些知识点总结起来,形成脉络体系,综合记忆,就会容易很多。小编将2018高考化学冲刺,化学反应热的计算知识总结如下:  一、热化学方程式 1.概念 表示参加反应物质的量和反应热的关系的化学方程式。 2.书写热化学方程式的“五步” 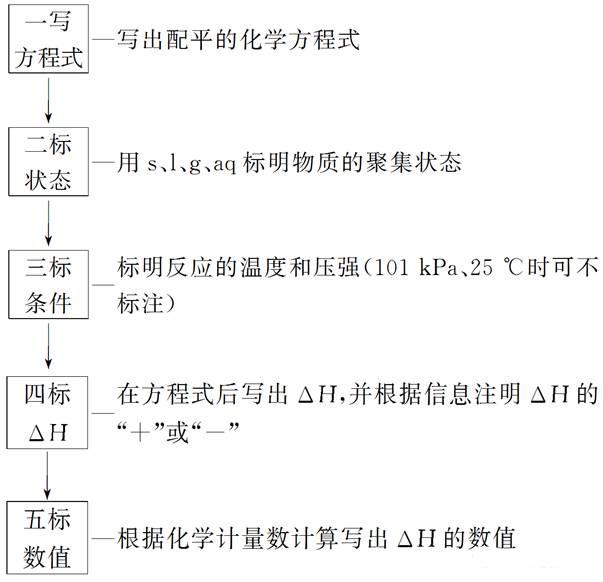 3.判断热化学方程式正误的“五审” 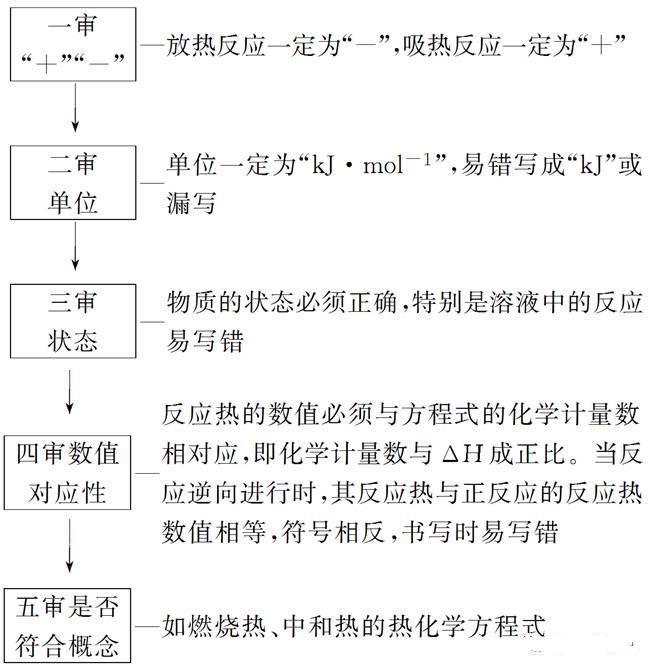 二、盖斯定律 1.内容 不管化学反应是一步或分几步完成,其反应热是相同的。或者说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。 如物质A变成C,有下列两种途径: 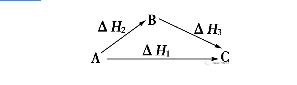 则有ΔH1=ΔH2+ΔH3。 2.解释 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主。 3.应用 对于进行得很慢的反应,不容易直接发生的反应,产品不纯(即有副反应发生)的反应,测定这些反应的反应热有困难,如果应用盖斯定律,就可以间接地把它们的反应热计算出来。 4.注意事项 (1)当热化学方程式乘以或除以某数时,ΔH也相应乘以或除以某数。 (2)当热化学方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”、“-”符号,即把ΔH看做一个整体进行运算。 (3)通过盖斯定律计算比较反应热的大小时,同样要把ΔH看做一个整体。 (4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,物质的状态由“固→液→气”变化时,会吸热;反之会放热。 (5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。 三、化学反应热的计算 1.反应热计算的依据 (1)根据热化学方程式计算。 反应热与反应物各物质的物质的量成正比,即ΔH1=nΔH。 (2)根据反应物和生成物的能量计算。 ΔH=生成物的能量和-反应物的能量和 (3)根据反应物和生成物的键能计算 ΔH=反应物的键能和-生成物的键能和 (4)根据盖斯定律计算。 将热化学方程式进行适当的“加”、“减”等变形后,由过程的热效应进行计算、比较。 (5)根据物质的燃烧热数值计算 Q(放)=n(可燃物)×|ΔH|。 (6)根据比热公式进行计算:Q=cmΔt。 2.反应热计算的常用解题方法 (1)列方程法:先写出热化学方程式,再根据热化学方程式所体现的物质与反应热间的关系直接求算反应热。 (2)估算法:根据热化学方程式所表示反应的热效应与混合物燃烧放出的热量,大致估算各成分的比例。 此法主要应用于解答选择题,根据题给信息找出大致范围,便可以此作依据找出答案,此法解题快速、简便。 文章来源于网络,由编辑整理,如有侵权请及时联系删除。 (责任编辑:admin) |