高考化学失分最严重的实验简答题专项总结,2021年高考生必看!
http://www.newdu.com 2025/12/01 12:12:27 三好网 佚名 参加讨论
今天高中化学老师给大家整理了近几年高考中出错率最高的高中化学实验简答题专项总结,解决高中生学习考试中得分难的问题!  1.实验前应如何检查该装置的气密性?(以试管为例) 答:(1)微热法:塞紧橡皮塞,将导管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)试管,烧杯中有气泡产生,冷却后,导管末端回升一段水柱,说明气密性良好。 (2)液差法:塞紧橡皮塞,用止水夹夹住导气管的橡皮管部分,从长颈漏斗中向试管中注水,使长颈漏斗中液面高于试管中液面,过一段时间,两液面差不变,说明气密性良好。 (若为分液漏斗,塞紧橡皮塞,用止水夹夹住导气管的橡皮管部分,向分液漏斗中加入一定量的水,打开活塞,若分液漏斗中液体滴下的速率逐渐减慢至不再滴下,说明气密性良好。) 2.在进行沉淀反应的实验时,如何认定沉淀已经完全? 答:在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,若不再产生沉淀,说明沉淀完全。如粗盐提纯实验中判断BaCl2已过量的方法是:在上层清液中再继续滴加BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。 3.化学实验中,过滤后如何洗涤沉淀?怎样检验沉淀是否洗涤干净?(以BaCl2沉淀Na2SO4为例) 答:向过滤器中注入蒸馏水,使水面没过沉淀物,待水滤出后,再加水洗涤,重复操作2-3次。 取少量最后一次洗涤洗液,滴加AgNO3溶液,若无沉淀产生,说明已洗涤干净。 4.(1)用图1(图一)装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是___________。该喷泉的原理是________________。 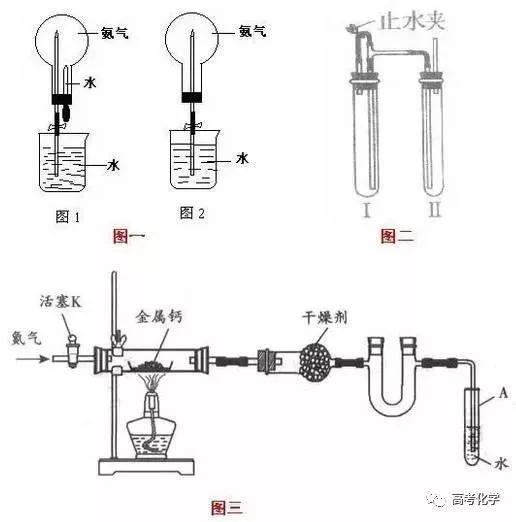 (2)如果只提供如图2的装置,请说明引发喷泉的方法。________。 答:(1)打开止水夹,挤出胶头滴管中的水。氨气极易溶解于水,致使烧瓶内压强迅速减小。 (2)打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。 5.引发铝热反应的操作是什么? 答:加少量KClO3,插上镁条并将其点燃。 6.常用的试纸有哪些?应如何使用? 答:(1)试纸种类: ①石蕊试纸(红、蓝色):定性检验溶液的酸碱性; ②pH试纸:定量(粗测)检验溶液的酸、碱性的强弱; ③品红试纸:检验SO2等有漂白性的物质; ④淀粉KI试纸:检验Cl2等有强氧化性的物质; ⑤醋酸铅试纸:检验H2S气体或其溶液。 (2)使用方法: ①检验液体:取一小块试纸放在表面皿或玻璃片上,用蘸有待测液的玻璃棒(或胶头滴管)点在试纸中部,观察试纸颜色变化。 ②检验气体:一般先用蒸馏水把试纸润湿,粘在玻璃棒的一端,并使其接近试管口,观察颜色变化。 (3)注意事项: ①试纸不可伸人溶液中也不能与管口接触。 ②测溶液pH时,pH试纸不能先润湿,因为这相当于将原来溶液稀释了。 7.烧杯中使用倒置漏斗可防止液体倒吸原理是什么? 答:当气体被吸收时,液体上升到漏斗中,由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯内,从而防止了倒吸。 8.只用一种试剂如何鉴别AgNO3、KSCN、稀H2SO4、NaOH四种溶液? 答:四种溶液各取少量,分别滴加FeCl3溶液,其中有白色沉淀生成的原溶液是AgNO3溶液,溶液变为血红色的原溶液是KSCN,有红褐色沉淀生成的原溶液是NaOH溶液,无明显变化的是稀H2SO4。 9.现在一个分液漏斗中,有水和苯的混合物,静置后,液体明显分为二层。请在滴管、试管、水、苯中选择器材和药品,用实验说明哪一层是水,哪一层是苯。 答:将分液漏斗中下层液体放入试管中少量,然后用滴管加入少量水(或苯),若试管内液体分层,则分液漏斗下层液体为苯(或水),若试管内液体不分层,则分液漏斗下层液体为水(或苯)。 10.如何检查容量瓶是否漏液? 答:往瓶内加入一定量水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水。 11.在中和滴定实验操作的要点是什么?如何判断滴定终点?(以标准氢氧化钠溶液滴定未知浓度的盐酸为例,酚酞作指示剂) 答:左手控制活塞(玻璃珠),右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,当滴入最后氢氧化钠溶液,溶液由无色变为浅红色,且半分钟内不恢复。 12.滴有酚酞的氢氧化钠通入SO2后溶液褪色,试通过实验证明。 答:向褪色后的溶液中再滴过量的氢氧化钠溶液,若溶液还能变红,说明是SO2酸性所致,若溶液不再变红,说明是SO2的漂白性所致。 14.焰色反应应如何操作? 答:将铂丝用盐酸洗过后放到无色火焰上灼烧至无色,再用铂丝蘸取样品,放到火焰上灼烧,观察火焰的颜色,(若是钾元素,则必须透过蓝色钴玻璃片观察)。 15.如何进行结晶蒸发操作? 答:将溶液转移到蒸发皿中加热,并用玻璃棒搅拌,待有大量晶体出现时停止加热,利用余热蒸干剩余水分。 16.下列实验设计和结论相符的是() A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液。答案:B 17.下列有关实验的叙述,不正确的是___。 A.用渗析法分离淀粉中混有的NaCl杂质 B.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止 C.配制100g10%的硫酸铜溶液时,称取10g硫酸铜晶体溶解于90g水中 D.鉴别溴乙烷:先加NaOH溶液,微热,冷却后再加AgNO3溶液 E.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热至沸腾,产生黑色沉淀,原因可能是NaOH量太少 F.进行中和热测定实验时,需测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度 G.用胶头滴管向试管滴液体时,滴管尖端与试管内壁一般不应接触 H.配制FeCl3溶液时,向溶液中加入少量Fe和稀硫酸 I.滴定用的锥形瓶和滴定管都要用所盛溶液润洗 J.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒 K.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸。答案:CDHIK 18.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。 下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是薄衣片,……,与VC(维生素C)同服可增加本品吸收。 某同学设计实验对其中的铁成分进行了验证。请一起完成该实验: 第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2和SO42-,也可以将Fe2+氧化成Fe3+。 第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有离子存在(填离子符号); 第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在。该离子存在的原因可能是(填序号): ①药品中的铁本来就是以三价铁的形式存在; ②在制药过程中生成少量三价铁; ③本实验过程中有少量三价铁生成。 第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。 第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。红色变深的原因是(用离子方程式表示):________;溶液红色又褪去的原因可能是:________;请自选中学实验室中常用仪器、药品,设计实验证明你的推测:________; 第六步:向B试管的溶液中加入一片VC片,片刻后溶液红色也褪去,说明VC有性;怎样理解药品说明中所述“与VC同服可增加本品吸收”这句话?  声明: (责任编辑:admin) |