高二化学选择性必修1第四章:第一节原电池知识点归纳
http://www.newdu.com 2025/11/24 11:11:49 三好网 佚名 参加讨论
高中化学老师给大家罗列出化学原电池中存在的常见知识点,希望可以对你的学习和复习都有所帮助,下面让我们正式开始吧!  01 原电池的工作原理  工作原理 负极:电子流出的电极——失电子,发生氧化反应(较活泼的金属) 正极:电子流入的电极——得电子,发生还原反应(较不活泼的金属、石墨等) 组成原电池的条件 ①具有不同的电极,较活泼的金属作负极,发生氧化反应; 较不活泼金属或非金属(石墨等)作正极,得到电子,发生还原反应,本身不变。 ②具有电解质溶液。 ③具有导线相连(或直接接触)组成闭合回路。 ④有能自发进行的氧化还原反应(有明显电流产生时需具备此条件) 原电池正负极的判断(重点,快拿小本本记下来) ①根据组成原电池的两极材料判断: 负极:活泼性较强的金属 正极:活泼性较弱的金属或能导电的非金属(石墨) ②根据电流方向或电子流动方向判断: 电流是由正极流向负极 电子流动方向是由负极流向正极 ③根据原电池两极发生的变化来判断: 负极:失电子发生氧化反应 正极:得电子发生还原反应 ④根据电极反应现象 负极:不断溶解,质量减少 正极:有气体产生或质量增加或不变 金属活泼性的判断 ①金属活动性顺序表 ②原电池的负极(电子流出的电极,质量减少的电极)的金属更活泼; ③原电池的正极(电子流入的电极,质量不变或增加的电极,冒气泡的电极)为较不活泼金属。 02 电极反应方程式的书写 1.电极反应式书写的一般步骤(很重要的哦): 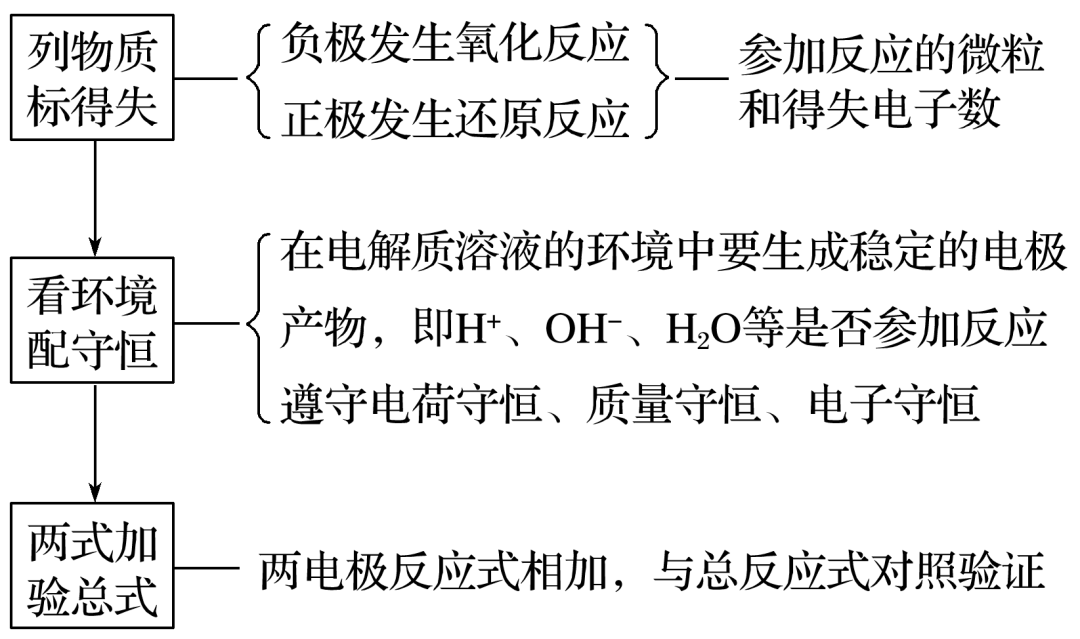 2.已知总方程式,书写电极反应式 (1)书写步骤 ①步骤一:写出电池总反应式,标出电子转移的方向和数目(ne-)。 ②步骤二:找出正、负极,失电子的电极为负极;确定溶液的酸碱性。 ③步骤三:写电极反应式。 负极反应:还原剂-ne-===氧化产物 正极反应:氧化剂+ne-===还原产物 (2)书写技巧 若某电极反应式较难写时,可先写出较易的电极反应式,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。如:CH3OCH3(二甲醚)酸性燃料电池中: 总反应式:CH3OCH3+3O2===2CO2+3H2O 正极:3O2+12H++12e-===6H2O 负极:CH3OCH3+3H2O-12e-===2CO2+12H+ 特别提醒简单电极反应中转移的电子数,必须与总方程式中转移的电子数相同。 3.氢氧燃料电池在四种常见介质中的电极反应总结  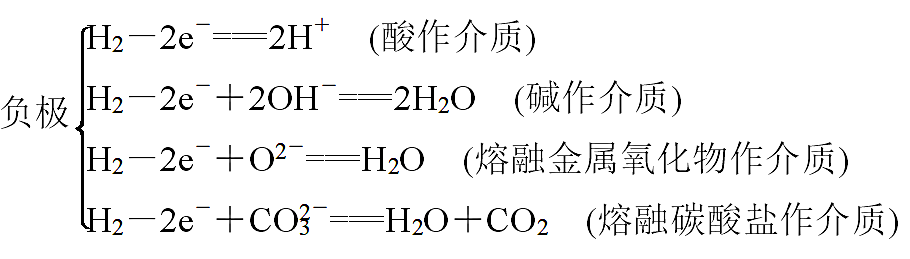 03 是骡子是马拉出来遛一遛 例题: 我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如图所示,其中固体薄膜只允许Li+通过。锂离子电池的总反应为xLi+Li1-xMn2O4LiMn2O4。下列有关说法错误的是() A.放电时,Li+穿过固体薄膜进入水溶液电解质中 B.放电时,正极反应为Li1-xMn2O4+xLi++xe-===LiMn2O4 C.充电时,电极b为阳极,发生氧化反应 D.该电池的缺点是存在副反应2Li+2H2O===2LiOH+H2↑ 答案D 解析Li为活泼金属,放电时,发生氧化反应,故电极a为负极,阳离子从负极移向正极,即Li+穿过固体薄膜进入水溶液电解质中,然后移向电极b,A、B项正确;充电时,电池正极接电源正极,发生氧化反应,是阳极,C项正确;由于固体薄膜只允许Li+通过,水不能与Li接触,故不存在Li与水的反应,D项错误。 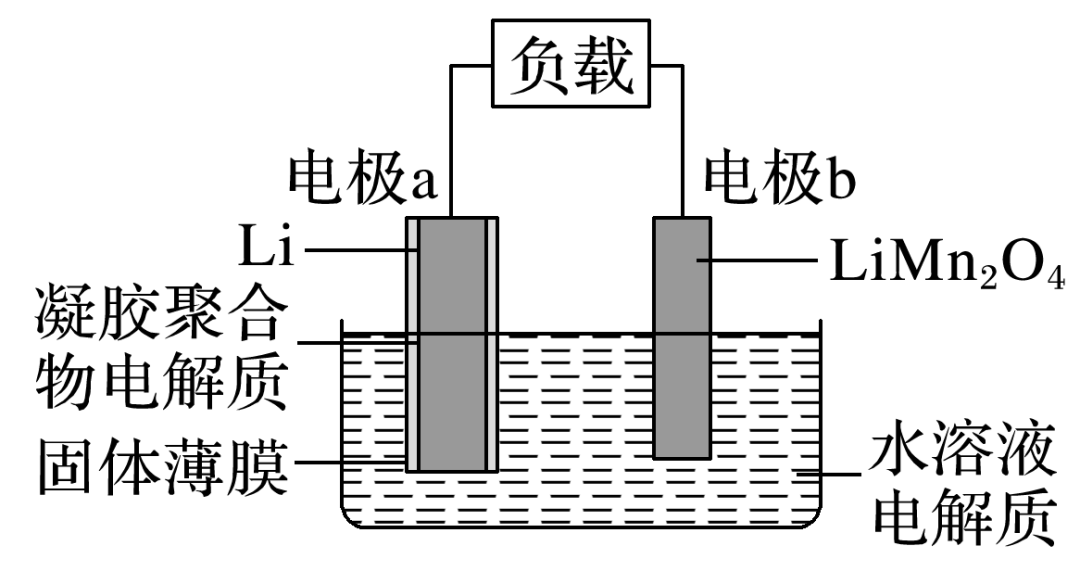 观后习题:  3.硼化钒-空气电池是目前储电能力最高的电池,电池示意图如下图所示,该电池工作时的反应为:4VB2+11O2===4B2O3+2V2O5,下列说法正确的是() A.电极a是电源负极 B.溶液中的OH-向a极移动 C.电子由VB2极经KOH溶液流向电极a D.VB2极发生的电极反应为:2VB2+22OH--22e-===V2O5+2B2O3+11H2O 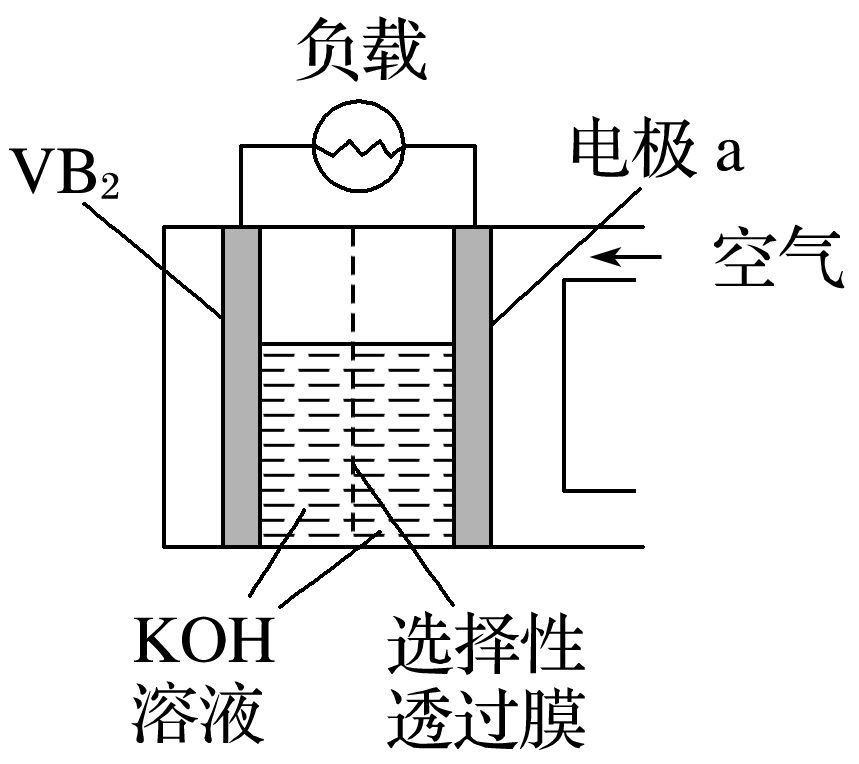 04 小方法 学习化学要善于用比较法,比较是对两种或两种以上易混淆的相关事物进行对比分析的一种常用方法。常用的比较方法有对立比较、差异比较和对照比较等。如在学习氧化还原反应时,氧化和还原、氧化剂和还原剂、氧化产物和还原产物等属于对立的概念,在学习过程中,我们抓住这些概念内部间的对立面来比较,对比记忆,以留下深刻的印象,实现记住一个就掌握另一个的一箭双雕的效果。又如对易混淆的同位素、同素异形体概念,要抓住这两个概念的相同点是什么,不同点有哪些,从而轻松掌握概念。 声明: (责任编辑:admin) |